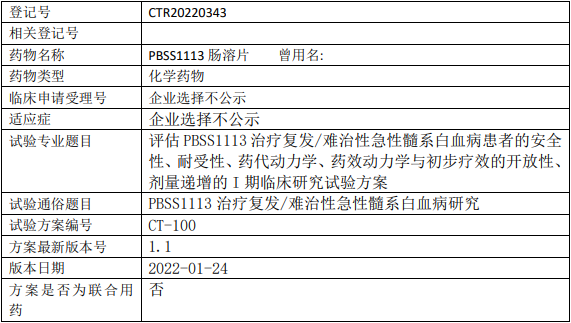
普济远成PBSS1113片临床试验,评估PBSS1113肠溶片治疗复发/难治性急性髓系白血病安全性、耐受性、药代动力学、药效动力学与初步疗效的I期临床试验
试验目的
主要目的
评价PBSS1113治疗复发/难治性急性髓系白血病患者中的安全性、耐受性,确定最大耐受剂量(MTD)以及II期推荐给药剂量(RP2D)。
次要目的
1)评价PBSS1113在复发/难治性急性髓系白血病患者中的药代动力学(PK)特征;
2)评价食物对PBSS1113在复发/难治性髓系白血病患者中的PK的影响;
3)观察PBSS1113在复发/难治性急性髓系白血病患者中的初步疗效。
探索性目的
1)评价PBSS1113在复发/难治性急性髓系白血病患者中的药效动力学(PD)特征;
2)探索PBSS1113的主要代谢产物在复发/难治性急性髓系白血病患者中的药代动力学(PK)特征。
试验设计
试验分类:其他其他说明:安全性、耐受性、药代动力学、药效动力学与初步疗效研究
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至70岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、符合以下所有标准的患者可考虑入组:
1)年龄18~70岁,男性或女性;
2)符合世界卫生组织(WHO)2016年版AML诊断标准,不适合现有治疗或经过≥2线治疗后的复发/难治性急性髓系白血病患者。
复发/难治性急性髓系白血病定义(依据中国诊疗指南2017年版):
①复发性AML诊断标准:完全缓解(CR)后外周血再次出现白血病细胞或骨髓中原始细胞>5%(除外巩固化疗后骨髓再生等其他原因)或髓外出现白血病细胞浸润;
②难治性AML诊断标准:经过标准方案治疗2个疗程无效的初治病例;CR后经过巩固强化治疗,12个月内复发者;12个月后复发但经过常规化疗无效者;2次或多次复发者;髓外白血病持续存在者;
3)美国东部肿瘤协作组(ECOG)体能状态评分为0~2;
4)预期生存期≥3个月;
5)器官功能水平基本正常:
a)总胆红素(TBIL)≤1.5倍正常值上限(ULN),AST和ALT≤3倍ULN;
b)血清肌酐≤1.5倍ULN且肌酐清除率≥60ml/min(根据CockcroftGault公式计算);
c)活化部分凝血酶原时间(APTT)≤1.5倍ULN,凝血酶原时间(PT)≤1.5倍ULN,国际化标准值(INR)≤1.5倍ULN;
d)左室射血分数≥50%;Fridericia法校正QT间期(QTcF)男性<450ms、女性<470ms;
6)能按照研究方案完成研究程序和随访检查者;
7)能够理解并自愿签署书面知情同意书,知情同意书必须在执行任何试验指定的研究程序前签署的患者。
排除标准
1、符合以下任何一条标准的患者不可入组:
1)诊断为急性早幼粒细胞白血病患者(法美英协作组分类AML-M3或2016年WHO诊断分型急性早幼粒细胞白血病伴PML-RARα);
2)除AML外罹患其他的恶性肿瘤(且该恶性肿瘤病情活跃),其他肿瘤(包括骨髓增生异常综合征、乳腺癌等)继发的AML患者;
3)筛选时白细胞(WBC)>25×10^9/L(允许服用羟基脲至给予试验药物前3天以稳定WBC计数);
4)男性、育龄妇女(必须已绝经至少12个月以上的绝经后妇女才能被认为无生育能力)以及他们的伴侣在治疗期间以及最后一次服用研究药物后至少3个月内不愿采取研究者认为有效的避孕措施,以及怀孕和哺乳期女性;
5)首次接受研究药物前14天内,接受了放射治疗、免疫治疗、激素治疗、靶向治疗、生物治疗、中药治疗、化疗或任何临床研究治疗的患者;
6)接受过造血干细胞移植的患者;
7)因既往化疗药物或放射治疗导致持续的毒性未恢复至CTCAE5.0版低于2级的患者(除外脱发);
8)首次接受试验药物前28天内进行过重大手术或出现显著的创伤性损伤,或预计在研究治疗期间需要进行重大手术;
9)根据研究者判断,有吞咽困难或任何影响药物吸收的胃肠道疾病的患者;
10)首次接受试验药物前14天内服用过CYP3A肝代谢酶的强抑制剂或诱导剂的患者;
11)有症状的活动性真菌、细菌和/或病毒性感染者;
12)已知存在HIV感染(抗-HIV阳性)、活动性乙肝(HBsAg检测阳性且HBVDNA≥2000拷贝/mL或≥500IU/mL),或活动性丙肝(HCV抗体检测阳性且HCV-RNAPCR检测结果阳性,或梅毒感染(梅毒螺旋体抗体检测阳性);非活动期的乙肝或丙肝需要在试验期间长期口服抗病毒药物的患者需要排除;
13)任何控制不佳的临床问题(如严重的精神、神经、心血管、呼吸、消化、泌尿、出凝血等系统疾病);
14)研究者认为患者不适合参与本研究的任何其他情形或状况。
