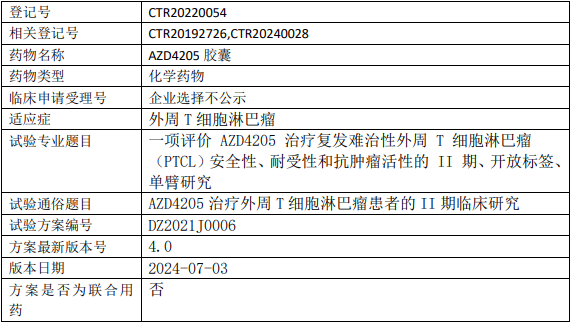
迪哲AZD4205临床试验,评价AZD4205(戈利昔替尼)胶囊治疗复发难治性外周T细胞淋巴瘤(PTCL)安全性、耐受性和抗肿瘤活性的II期临床试验
试验目的
1、评估AZD4205(戈利昔替尼)胶囊在复发难治性外周T细胞淋巴瘤患者中的疗效、安全性、耐受性;
2、探索AZD4205治疗PTCL的可能作用机制。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、受试者必须在任何研究特定的程序、取样和分析之前提供一份已签署的、注明日期的书面知情同意书。
2、年龄≥18周岁。
3、ECOG状态评分0-2,且近2周内无明显恶化。
4、预期寿命≥12周。
5、受试者须有经组织病理确诊过的外周T细胞淋巴瘤。
6、受试者必须存在基于2014版LUGANO标准所定义的可测量病灶。
7、受试者必须在标准治疗的基础上出现疾病进展或治疗无效,或不能够耐受。受试者在进入本研究时应不适合进行骨髓移植治疗。
8、足够的骨髓造血功能储备及脏器功能。
排除标准
1、既往有异体造血干细胞移植史;或6个月内接受过自体造血干细胞移植。
2、既往使用过JAK或STAT3抑制剂。
3、在本研究开始给药前1周内还在使用等效剂量>15mg/日泼尼松的甾体类激素治疗。
4、在本研究开始给药前存在未缓解的大于CTCAE1级的药物毒性反应(脱发除外)。
5、淋巴瘤累及中枢神经系统或脑膜。
6、患者存在明显心、肺功能受损的情况。
7、患者疾病情况需要使用免疫抑制剂或类似生物制剂、非甾体类解热镇痛药(NSAID)治疗。
8、活动性感染。
9、哺乳期妇女支持治疗不能够良好控制的顽固性恶心、呕吐,慢性胃肠道疾病,胶囊吞咽困难,或既往手术切除肠段可能会影响药物充分吸收的。
10、研究者判断或其他证据显示患者存在严重的或控制不良的系统性疾病哺乳期妇女。
11、研究者判断或其他证据显示患者存在严重的或控制不良的系统性疾病。
