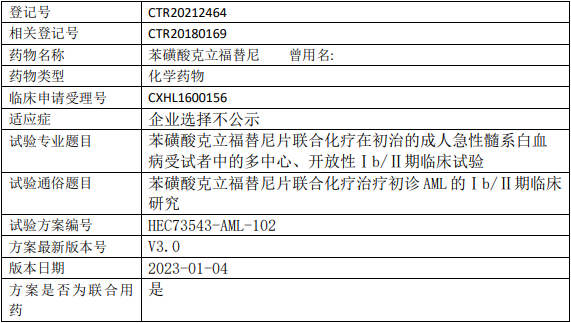
东阳光药业克立福替尼临床试验,苯磺酸克立福替尼片联合化疗治疗初治的成人急性髓系白血病多中心、开放性的Ⅰb/Ⅱ期临床试验
试验目的
1、评估克立福替尼联合DA(阿糖胞苷+柔红霉素)或AZA(阿扎胞苷)在初治的成人AML受试者中的耐受性和安全性;
2、观察剂量限制性毒性(DLT),确定最大耐受剂量(MTD)或扩展推荐剂量(RED),为后续临床试验给药剂量和给药方案提供理论依据;
3、评估克立福替尼联合DA或AZA在初治的成人AML受试者中的疗效。
试验设计
试验分类:安全性和有效性
试验分期:其它其他说明:Ⅰb/Ⅱ期
设计类型:平行分组
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄≥18周岁,性别不限;
队列1:18周岁≤年龄≤65周岁;
队列2:剂量递增试验仅纳入年龄≥60周岁的AML受试者;扩展试验纳入年龄≥60周岁或年龄在18周岁~59周岁(包含18和59周岁)且满足不能耐受强化疗的受试者
2、经骨髓细胞形态学和免疫表型确认的,新诊断的符合世界卫生组织(WHO)分类的急性髓系白血病,可为原发性AML或继发于MDS的AML,并且未经治疗;扩展阶段要求受试者FLT3-ITD突变阳性
3、ECOG评分根据不同组别要求如下:
队列1:0~1分;
队列2:年龄≥60周岁:0~2分;年龄在18~59周岁(包含18和59周岁):0~3分;
4、预期生存时间≥12周;
5、有充足的器官功能
6、有生育能力的女性受试者:非哺乳期,筛选期血妊娠检查必须为阴性,且同意自签署书面知情同意书开始至末次服用试验药物后6个月内采取高效避孕措施。未绝育的男性受试者:同意自签署书面知情同意书开始至末次服用试验药物后6个月内采取高效避孕措施。
7、受试者须愿意提供已有的有效诊断证据,并愿意接受骨髓穿刺(必要时接受骨髓活检);
8、受试者自愿参加本研究,并由本人或监护人签署了书面知情同意书。
排除标准
1、符合以下任一情况的既往治疗史:
●诊断患有急性早幼粒细胞白血病(APL),法国-美国-英国分类(即FAB分类)M3型或WHO分类的APL,并表现为t(15;17)(q22;q12)染色体易位,或BCR-ABL阳性白血病(即慢性粒细胞白血病原始细胞危象);
●诊断为继发于既往由于其他肿瘤化疗或放疗的AML;
●既往接受过FLT3抑制剂;
●首次用药前2周内接受过抗肿瘤中药(经NMPA批准有抗肿瘤适应症)治疗;
●首次用药前4周内接受过活疫苗(包括减毒活疫苗)和/或计划研究用药期间接受活疫苗;
●首次用药前4周内参加过任何干预性临床试验(参与一项研究的总生存期随访受试者除外);
2、骨髓增殖性肿瘤(MPN)或急性淋巴细胞白血病(ALL)继发的AML;
3、既往或现在有中枢神经系统浸润者
4、首次用药前5年内合并其他恶性肿瘤
5、队列1:有实体器官移植病史;队列2:有实体器官移植病史,除肾移植史外;
6、以下任意一项心血管风险因素:
●QTcF均值>450ms(QTcF即采用Fridericia校正公式QTcF=QT/RR0.33计算),或者有先天性长QT间期综合征病史;
●任何具有明显临床意义的室性心律失常病史(如室性心动过速、室性纤维性颤动或尖端扭转型室性心动过速);
●首次用药前12个月内患有以下任意一种疾病者:心肌梗死、冠状动脉搭桥或外周动脉搭桥植入手术者;
●首次用药前6个月内有不稳定型心绞痛;
●难以控制的高血压(尽管接受了降压药物治疗,但收缩压>160mmHg,和/或舒张压>100mmHg),或既往曾出现高血压危象或高血压性脑病;
●仅针对队列1的受试者:左心室射血分数(LVEF)<50%和/或NYHA功能分级Ⅲ~Ⅳ级的心力衰竭;
●NYHA功能分级Ⅳ级的心力衰竭(仅适用于队列2的受试者);
7、肺功能检测提示受试者DLCO≤50%或FEV1≤60%,或休息时呼吸困难或需要持续氧气吸入
8、首次用药前12个月内出现过血栓形成或栓塞事件
9、有不能控制的、活动性感染,包括但不限于以下情况:
●经研究者判断,筛选期有不能控制的全身性活动性感染;
●患有先天或后天免疫功能缺陷(如HIV感染者);
●活动性乙肝或丙肝:筛选期HBsAg阳性或者HBcAb阳性的受试者,需要检测HBV DNA,HBV DNA定量≥104cps/mL或≥2000IU/mL;
●筛选期HCV抗体检测结果为阳性的受试者,需进一步检测HCV RNA且HCV RNA定量检测阳性;
10、临床上明显的胃肠道异常,可能影响药物的摄入、转运或吸收(如无法吞咽、慢性腹泻、肠梗阻等),或全胃切除的受试者;
11、需长期服用可能延长QTcF的药物
12、有精神类药物滥用史且无法戒除者或有精神障碍者;
13、研究者认为患有其它严重急性或慢性疾病、不适合参加临床试验者。
