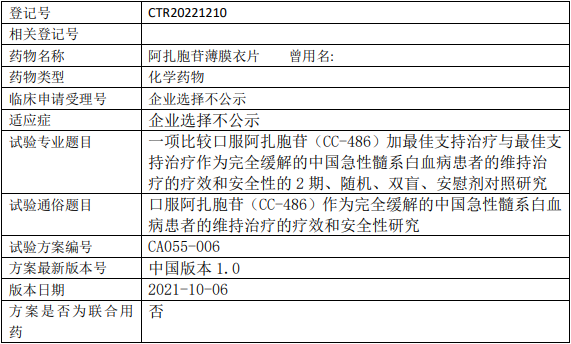
新基医药阿扎胞苷临床试验,比较口服阿扎胞苷薄膜衣片(Onureg、CC-486)加最佳支持治疗与最佳支持治疗作为完全缓解的急性髓系白血病维持治疗的疗效和安全性的II期临床试验
试验目的
主要目的
评价CC-486维持治疗与安慰剂相比是否可改善首次达到完全缓解(CR)或血细胞计数未完全恢复的完全缓解(CRi)的急性髓系白血病(AML)患者的无复发生存期(RFS)。
次要目的
1、确定CC-486维持治疗与安慰剂相比对首次达到CR/CRi的AML受试者的总生存期(OS)的影响;
2、确定CC-486维持治疗与安慰剂相比对首次达到CR/CRi的AML受试者其他疗效终点的影响;
3、评估CC-486在AML受试者中的安全性和耐受性;
4、表征CC-486在AML受试者中的药代动力学;
5、评价骨髓中残留病灶的预后和治疗意义;
6、确定CC-486与安慰剂相比对健康相关生活质量(HRQoL)和医疗资源利用的影响。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:55岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、签署书面知情同意书。
2、新诊断、组织学确认的原发性AML或继发于既往骨髓增生异常综合征(MDS)或慢性粒单核细胞白血病(CMML)的AML。
3、年龄≥55岁。
4、ECOG体能状态为0、1、或2。
5、接受过强化诱导化疗伴或不伴巩固治疗后首次达到CR/CRi状态。
排除标准
1、根据形态学、免疫表型、分子检测或核型,怀疑或证实为急性早幼粒细胞白血病(APL,FABM3);或AML伴既往血液系统疾病,如慢性髓系白血病或骨髓增殖性肿瘤,除外MDS和CMML。
2、伴有inv(16)、t(8;21)、t(16;16)、t(15;17)或t(9;22)核型或有这些易位的分子学证据的AML。
3、已被证明患有中枢神经系统白血病。
4、使用去甲基化药物治疗后达到了CR/CRi。
5、既往进行过骨髓或干细胞移植。
6、筛选时适合接受异基因骨髓或干细胞移植。
7、受试者存在以下任何实验室检查异常:
●中性粒细胞绝对计数<0.5×10^9/L;
●血小板计数<20×10^9/L;
●血清胆红素>1.5×正常值上限(ULN);
●血清天冬氨酸氨基转移酶或丙氨酸氨基转移酶>2.5×ULN;
●血清肌酐>2.5×ULN。
8、可能干扰或妨碍受试者参加研究的任何重大医学疾病、活动性感染(包括疑似或确诊的严重急性呼吸综合征冠状病毒-2[SARS-CoV-2])、实验室检查异常或精神疾病。
9、可能干扰或妨碍受试者参加研究的任何重大医学疾病、活动性感染(包括疑似或确诊的严重急性呼吸综合征冠状病毒-2[SARS-CoV-2])、实验室检查异常或精神疾病。
