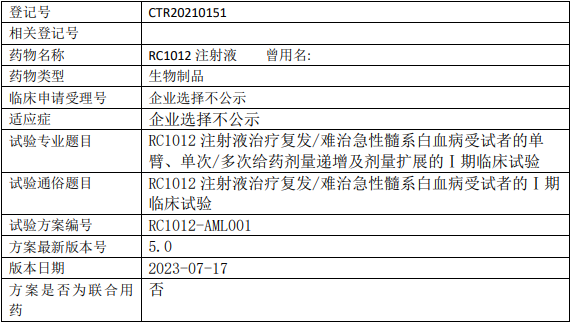
瑞创生物RC1012临床试验,RC1012注射液治疗复发/难治急性髓系白血病单臂、单次/多次给药剂量递增及剂量扩展的I期临床试验
试验目的
主要目的
1、评价在复发/难治急性髓系白血病(relapsedorrefractoryAcuteMyelocyticLeukemia,r/rAML)受试者中输注RC1012注射液的安全性和耐受性;
2、确定其最大耐受剂量(MaximumToleratedDose,MTD)和/或II期临床推荐剂量(RecommendedPhaseIIDose,RP2D)和后续临床试验给药方式。
次要目的
1、评价在r/rAML受试者中输注RC1012注射液的DNT细胞药代动力学特征;
2、评价r/rAML受试者输注RC1012注射液后的初步疗效。
探索目的
探索r/rAML受试者输注RC1012注射液前后体内细胞因子、抗药抗体、免疫细胞表型和分子分型、染色体等的变化。
试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至70岁(最大年龄)
性别:男+女
健康受试者:有
出入排标准
入选标准
1、自愿签署知情同意书并预期能完成研究程序的随访检查与治疗;
2、年龄18~70岁(含界值),性别不限;
3、符合2016年WHO分型的AML诊断,并符合2022年欧洲白血病网(ELN)指南及2023年2月CDE发布的《急性髓系白血病新药临床研发技术指导原则》中复发和难治的诊断标准:
a.复发性AML诊断标准:CR、CRi或CRh后外周血再次出现白血病细胞或骨髓中原始细胞≥5%(除外巩固化疗后骨髓再生等其他原因)或髓外出现白血病细胞浸润;
b.难治性AML诊断标准:经标准方案(包含阿糖胞苷及一种蒽环类或蒽醌类药物)诱导化疗两个疗程后未获“完全缓解”的原发难治性疾病;
4、患者已经从先前治疗的毒性中恢复,即CTCAE毒性分级<2级(除非异常与肿瘤有关);
5、ECOG体能状态评分0~1分;
6、具有合适的器官功能,在清淋化疗前7天内实验室检查结果需符合以下标准:
a.谷草转氨酶(AST)≤3倍正常值上限(upperlimitofnormal,ULN);
b.谷丙转氨酶(ALT)≤3倍ULN;
c.总胆红素≤1.5倍ULN,除非受试者有Gilbert综合征的记录;总胆红素≤3.0倍ULN且直接胆红素≤1.5倍ULN的Gilbert-Meulengracht综合征受试者可以纳入;
d.血清肌酐≤1.5倍ULN,或者肌酐清除率≥60mL/min;f.左心室射血分数(LVEF)≥45%;
7、育龄期女性受试者在筛选期进行妊娠试验为阴性;任何有生育能力的男性和女性受试者须同意在签署知情同意书始至细胞输注结束后至少半年内使用有效的避孕方法。没有生育能力的女性受试者(即,满足以下至少1条标准):
a.已行子宫切除术或双侧卵巢切除术,或;
b.经医学确认卵巢衰竭,或;
c.医学确认为绝经后(无病理性或生理性原因的情况下,至少连续12个月停经)。
排除标准
1、诊断为急性早幼粒细胞白血病;
2、白血病髓外浸润者;
3、有中枢神经系统侵犯或颅脑神经病变的证据或病史;
4、乙肝表面抗原(HBsAg)或乙肝核心抗体(HBcAb)阳性且外周血乙型肝炎病毒(HBV)DNA滴度检测不在正常参考值范围内;丙型肝炎病毒(HCV)抗体阳性且外周血丙型肝炎病毒(HCV)RNA阳性者;人体免疫缺陷病毒(HIV)抗体阳性者;巨细胞病毒(CMV)DNA检测阳性者;梅毒检测阳性者;
5、对RC1012注射液的辅料(如:人血白蛋白)或研究方案中建议使用的其他药品(如:淋巴细胞清除药、托珠单抗)过敏者;
6、患有严重心脏疾病,包括但不限于严重心律不齐、不稳定性心绞痛、大面积心梗、纽约心脏病协会Ⅲ级或Ⅳ级的心功能不全、难治性高血压(难治性高血压定义是:在改善生活方式的基础上应用了合理可耐受的足量≥3种降压药物(包括利尿剂)治疗>1月血压仍未达标或服用≥4种降压药物血压才能有效控制)者;
7、既往接受过器官移植或准备接受器官移植者(造血干细胞移植除外);
8、存在Ⅲ~IV度急性GvHD或广泛型慢性GvHD(Graft-vs-hostdisease,GvHD)者;
9、筛选前2个月内接受过造血干细胞移植者;
10、活动性神经系统自身免疫或炎症性疾病(如:格林-巴利综合征(GBS),肌萎缩侧索硬化症(ALS))和有临床意义的活动性脑血管疾病(如,脑水肿,后部可逆性脑病综合征(PRES));
11、预期寿命小于3个月者;
12、筛选前3个月内参与其他临床研究者;
13、按照研究者的判断和/或临床标准,对任何研究程序有禁忌或有其他医学情况可能使其面临不可接受的风险的患者。
