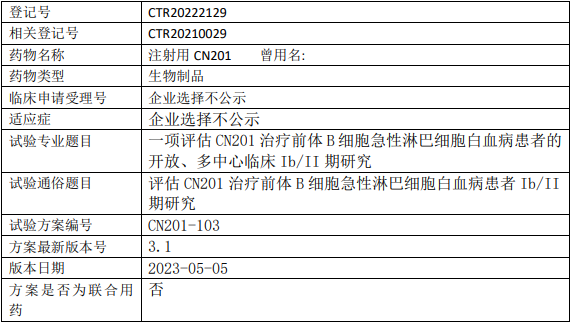
同润生物CN201临床试验,评估注射用CN201治疗前体B细胞急性淋巴细胞白血病患者的开放、多中心的Ib/II期临床试验
试验目的
Ib期主要目的
1、评估CN201的安全性和耐受性;
2、评估CN201的剂量限制性毒性(DLT)和最大耐受剂量(MTD);
3、确定CN201的II期推荐剂量(RP2D)。
II期主要目的
评估CN201治疗复发或难治的B-ALL患者的抗白血病疗效。
Ib期次要目的
1、评估CN201在B-ALL患者体内的PK特征;
2、评估CN201在B-ALL患者体内的药效动力学特征;
3、评估CN201的免疫原性;
4、评估CN201的抗白血病活性。
II期次要目的
1、进一步评估CN201的安全性和耐受性;
2、进一步评估CN201在患者体内的PK特征;
3、进一步评估CN201在患者体内的药效动力学特征;
4、进一步评估CN201的免疫原性;
5、进一步评估CN201在复发或难治的B-ALL患者中的抗白血病活性。
试验设计
试验分类:安全性和有效性
试验分期:其它其他说明:Ib/II期设
计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、骨髓中有5%以上原始淋巴细胞的B-ALL患者。
2、ECOG体力评分≤2分。
3、预计生存时间3个月以上。
4、器官功能充分
5、具有生育能力的女性受试者必须未怀孕且未哺乳,并且同意保持禁欲(避免异性性交)或采取高效的双重避孕措施,从筛查到CN201末次给药后90(±7)天为止。在此期间,女性不得捐献卵子。
6、受试者必须能够充分理解并签署知情同意书。
排除标准
1、伯基特(Burkitt)白血病患者
2、在首次使用试验用药品前12周内接受过异基因造血干细胞移植的患者。
3、在首次使用试验用药品前14天内接受过放疗或化疗(鞘内化疗和地塞米松除外)。
4、在首次使用试验用药品前21天内接受过免疫治疗。
5、在首次使用试验用药品前21天内接受过其他未上市的临床试验用药品的患者。
6、在首次使用试验用药品前4周内接受过主要脏器外科手术(不包括穿刺活检)或出现过显著外伤,或需要在试验期间接受择期手术的患者。
7、在首次使用试验用药品前4周内使用过减毒活疫苗的患者,以下情况特殊说明:
a.允许使用经批准的2019冠状病毒病(COVID-19)疫苗,但最后一剂COVID-19疫苗必须在CN201首次用药前至少2周接种。
b.对于已经参加本研究的受试者,在完成8周的治疗并获得安全性数据后,允许接种COVID-19。
8、既往抗肿瘤治疗的非血液学相关不良反应尚未恢复到NCI-CTCAE5.0版等级评价≤1级(脱发等研究者判断无安全风险的毒性除外)的患者。
9、既往或伴有CNS疾病的患者,包括:癫痫、出血性/缺血性脑卒中、严重脑损伤、痴呆、帕金森病、小脑疾病、器质性脑综合征、精神疾病等。
10、伴有中枢神经系统(CNS)浸润的患者。既往曾有中枢神经系统浸润,但采用鞘内注射治疗已经得到控制的患者是允许入组的。
11、有活动性感染,且在首次用试验用药前仍需要静脉抗感染治疗的患者。
12、有免疫缺陷病史的患者,包括人类免疫缺陷病毒(HIV)抗体检测阳性史。
13、有乙型肝炎和/或丙型肝炎的患者。筛选期乙肝表面抗原(HBsAg)阳性和/或乙肝病毒DNA阳性,或丙型肝炎病毒(HCV)抗体阳性的患者。
14、目前或曾患有间质性肺病的患者。
15、伴有其他恶性肿瘤的患者(除经过充分治疗的非黑素瘤性皮肤癌、原位导管癌、浅表性膀胱癌、前列腺癌、或原位宫颈癌),除非在进入研究前至少5年完全缓解,并且在研究期间不需要额外的治疗的患者。
16、有严重的心脑血管疾病史的患者。
17、研究者判定无法控制的积液(如胸腔积液、腹腔积液、盆腔积液等)
18、患有活动性或曾患过且有可能复发的自身免疫性疾病(如系统性红斑狼疮、类风湿性关节炎、炎症性肠病、自身免疫性甲状腺疾病、血管炎、银屑病等),或有可能累及中枢神经系统的自身免疫性疾病史者。
19、目前有急性移植物抗宿主疾病(GVHD),根据Glucksberg标准分级为2-4级,或有需要系统治疗的活动性慢性GVHD的患者。
20、在首次使用试验用药品前14天内进行抗GvHD治疗的患者。
21、曾接受免疫治疗并出现≥3级免疫相关不良事件(irAE)的患者。
22、已知有酒精或药物依赖的患者。
23、精神障碍者或依从性差的患者。
24、研究者认为患者存在其他原因而不适合参加本临床研究。
