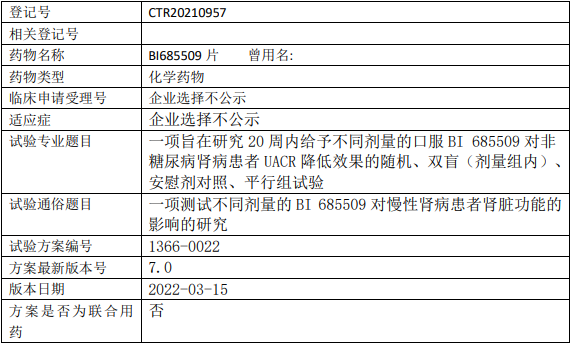
勃林格殷格翰BI685509片临床试验,测试不同剂量BI685509片对慢性肾病肾脏功能影响的II期临床试验
试验目的
本试验的主要目的是通过在非糖尿病肾病患者中评估3个剂量和安慰剂,确定BI685509的有效性,并表征BI685509的剂量-效应关系。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1.在进入试验之前,依照ICH-GCP和当地法规要求在书面知情同意书上签署姓名和日期。
2.签署知情同意书时,男性或女性患者的年龄均≥18岁。
3.访视1时,中心实验室分析得出eGFR(慢性肾脏疾病流行病学协作[CKD-EPI]公式)≥20且<90mL/min/1.73m2。访视1后直至访视3开始,通过中心或任何当地实验室分析测量的eGFR必须保持≥20mL/min/1.73m2。
4.访视1时,中心实验室分析所得点尿(中段尿样本)中的UACR≥200且<3500mg/g1。
5.有大量白蛋白尿(>300mg/g)的患者应接受最高耐受剂量的ACEi或ARB(但并非两者联用)治疗。对于微量白蛋白尿患者,由研究者决定是否使用ACEi或ARB。访视1前应以稳定剂量治疗≥4周,试验期间不计划改变治疗。
6.如果患者正在使用以下任何药物,应在访视1前至少4周时使用稳定剂量治疗,并持续至治疗开始,且试验期间未计划改变治疗方案:降压药、NSAID、内皮素受体拮抗剂、低剂量全身性类固醇或SGLT2抑制剂。
7.根据研究者判断,诊断为任何一种临床上认为其主要原因不是由糖尿病引起的慢性肾脏病
8.访视1时坐位SBP≥110且≤160mmHg,DBP≥65且≤110mmHg,并根据当地标准治疗和研究者判断接受最佳降压治疗2。
9.访视1时的体重指数(BMI)≥18.5且<50kg/m2。
10.如果其性伴侣是育龄期女性3(WOCBP),有生育能力的男性患者必须愿意使用避孕套。WOCBP必须准备并能够根据ICHM3(R2)采取高效的避孕方法。此类方法应在整个试验中持续使用。符合这些标准的避孕方法列表见患者须知和方案第4.2.2.3节。
排除标准
1.访视1前4周内以及整个筛选和基线导入期接受肾素血管紧张素醛固酮系统RAAS干预(ACEi或ARB除外)、磷酸二酯酶-5抑制剂、非特异性磷酸二酯酶抑制剂(如双嘧达莫和茶碱)、NO供体(包括硝酸盐)、sGC刺激剂/激活剂(试验治疗除外)或研究者文件夹(ISF)中规定的任何其他限制药物(包括OATP1B1/3抑制剂、UGT抑制剂/诱导剂)治疗。必须或希望继续服用限制药物(参见第4.2.2.1节)或服用被认为可能干扰试验安全进行的任何药物的患者
2.研究者认为会使患者面临更多风险的从筛选到开始试验治疗期间出现的任何与临床相关的实验室检查值。
3.诊断为糖尿病肾病。
4.在访视1前3个月内以及整个筛选和基线导入期内接受任何免疫抑制疗法或免疫疗法(泼尼松龙≤10mg或同等药物等效剂量除外)。
5.在访视1前30天内直至开始试验治疗期间,患有符合改善全球肾脏病预后组织(KDIGO)定义4(R17-2439)的急性肾损伤(AKI)。
6.计划在试验期间开始慢性肾脏替代治疗或在试验治疗开始前患有终末期肾脏疾病。
7.试验治疗开始前,根据研究者判断,已知有中度或重度症状性直立性调节障碍史。
8.患者患有SARS-CoV-2活动性感染(或已知从筛选到随机化期间检测结果阳性)。
9.在访视1前的最近两年内,有癌症病史或癌症治疗史(经适当治疗的皮肤基底细胞癌、原位宫颈癌和低分级[T1或T2]前列腺癌除外)。
10.试验期间计划进行大手术(根据研究者的判断)。
11.可能会干扰试验参与的临床相关过敏/超敏反应史,包括对研究药物/安慰剂或其辅料过敏(参见研究者手册c02778238)
12.研究者认为可能对患者构成安全风险或可能干扰试验目的的任何其他医疗状况。
13.既往在本试验中曾接受随机化。
14.目前入组另一项试验用器械或药物试验。1.或自结束针对一种口服制剂(该口服制剂未在任何其他排除标准中予以指明)的其他研究器械或药物试验以后,距访视1前的时间少于30天或5个半衰期(以较长者为准),2.或自结束针对一种生物制剂(第4.2.2节表4.2.2.1内的排除标准或限制中未予以指明)的其他研究器械或药物试验以后,距访视1前的时间少于12个月3.或接受其他研究治疗。
15.长期酗酒或药物滥用,或者研究者认为患者不适宜作为本临床试验受试者或不太可能完成本临床试验的任何情况。
16.妊娠期、哺乳期或计划在试验期间怀孕的女性。
17.从筛选(访视1)至开始治疗之间的任何时间点,男性QTcF间期>450ms,女性QTcF间期>470ms。
18.具有长QT综合征家族史。
19.于筛选(访视1)时,以及在整个筛选期间和基线导入期间合并使用已知存在尖端扭转型室速诱发风险的治疗,或在试验期间计划开始此类治疗(参考第4.2.2.1节)
20.潜在病因是以下病因之一的患者:恶性肿瘤导致的继发性CKD(如管型肾病,AL-淀粉样变性肾病);传染性疾病导致的继发性CKD(如肝炎-/HIV-相关性肾病);常染色体显性多囊肾病
研究者信息
主要研究者
姓名:赵明辉
学位:医学博士
职称:主任医师
单位名称:北京大学第一医院
国内参加医院
| 序号 | 医院名称 | 主要研究者 | 医院地址 |
| 1 | 北京大学第一医院 | 赵明辉 | 北京市西城区西什库大街8号 |
| 2 | 重庆医科大学附属第二医院 | 廖晓辉 | 重庆市市辖区渝中区临江路74号 |
| 3 | 四川省人民医院 | 王莉 | 四川省成都市青羊区一环路西2段32号 |
| 4 | 宣城市人民医院 | 陈忠辉 | 安徽省宣城市宣州区大坝塘路51号 |
| 5 | 北京大学第三医院 | 何莲 | 北京市海淀区花园北路49号 |
| 6 | 北京大学人民医院 | 左力 | 北京市西城区西直门南大街11号 |
