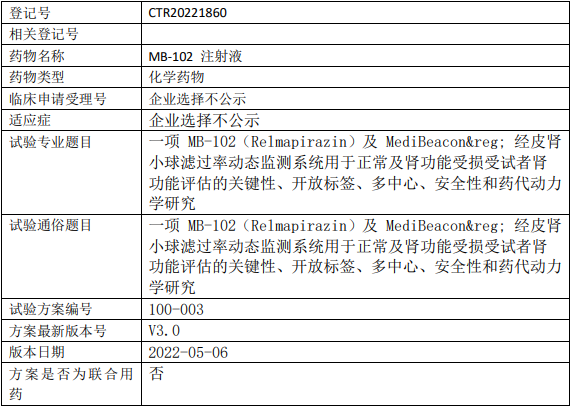
华东制药MB-102临床试验,评价MB-102注射液(Relmapirazin)及MediBeacon用于正常及肾功能受损受试者肾功能评估的III期临床试验
试验目的
1、旨在表明使用MediBeacon®经皮肾小球滤过率动态监测系统测量的MB-102经皮荧光GFR与MB-102血浆GFR的一致性
2、旨在评估单剂量MB-102用于受试者的安全性和耐受性
3、旨在受试者中,评估使用MediBeacon®经皮肾小球滤过率动态监测系统经皮无创监测MB-102荧光的安全性和有效性
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:开放
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:有
出入排标准
入选标准
1.年龄≥18岁的男性或女性:
a.非妊娠期女性受试者,非育龄期或愿意在研究期间使用可靠避孕措施
b.男性受试者必须愿意从给药当天开始至给药后至少7天保持禁欲,或使用可靠的避孕措施
c.对于育龄期女性,受试者在筛选期妊娠试验结果应为阴性,且同意正确使用以下一种可接受的避孕方法:禁欲,口服避孕药(联合或单独使用孕酮);注射避孕法,左炔诺孕酮植入术、雌激素阴道环、经皮避孕贴剂、宫内节育器或节育系统、或男性伴侣绝育
d.在整个研究期间及末次研究给药后1个月内,男性受试者不得捐精
2.有能力直接提供知情同意,且能够遵守本研究方案所述要求和规定的受试者。
3.静脉条件允许按方案所述要求进行采血
排除标准
1.COVID-19PCR检测阳性
a.接种疫苗后且无COVID-19症状的受试者不需要进行PCR检测,但可由研究中心自行决定是否进行检测
2.近期献血或失血(血液或血浆):研究药物首次给药前30天内,献血量或失血量到达100mL至499mL;或研究药物首次给药前56天内,超过499mL
3.MB-102给药前3天内使用非甾体抗炎药(NSAID)
4.受试者参加了其他临床研究并接受了试验药物,且在本研究给药日第一天时仍处在以下时间范围内:其他试验药物用药后30天或5个半衰期内(以较长时间为准)
5.对粘合剂有皮肤过敏史(如:创可贴、外科胶带)
6.严重的过敏反应史(不可接受的不良事件)或对任何过敏原(包括药物、MB-102或其他相关产品)的过敏反应史(药物不耐受不视为药物过敏)
7.任何可能会增加研究参与或研究药物给药风险,或研究者认为可能干扰研究结果解读的情况,如急性或慢性疾病,心脏、实验室或体格检查异常。
8.胸骨或其他传感器放置位置有明显的瘢痕、纹身或色素沉着变化,有可能造成传感器读数相对于其他皮肤区域数值出现改变
9.研究者认为可能限制受试者完成试验,或可能使受试者面临更大风险,或影响研究结果解释的任何严重或不受控制的医学疾病、活动性感染、体格检查异常发现、实验室检查异常发现或精神疾病
10.目前正在接受透析治疗
11.目前无尿
12.血清妊娠试验阳性
13.eGFR>120mL/min/1.73m2
研究者信息
主要研究者
| 姓名 | 学位 | 职称 | 医院名称 |
| 赵明辉 | 博士 | 主任医师 | 北京大学第一医院 |
| 崔一民 | 博士 | 主任医师 | 北京大学第一医院 |
各参加医院
| 序号 | 医院名称 | 主要研究者 | 医院地址 |
| 1 | 徐州医科大学附属医院 | 孙东 | 江苏省徐州市泉山区淮海西路99号 |
| 2 | 复旦大学附属华山医院 | 张菁、薛骏 | 上海市静安区乌鲁木齐中路12号 |
| 3 | 四川大学华西医院 | 冯萍、付平 | 四川省成都市武侯区国学巷37号 |
