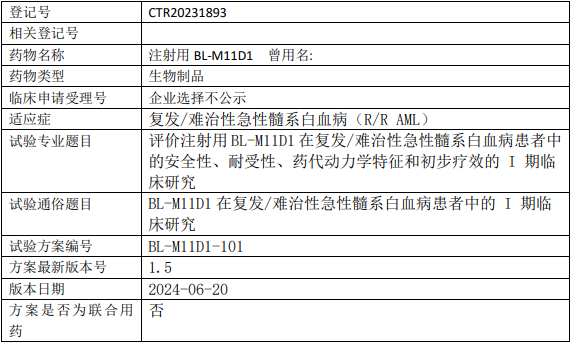
百利多特/百利药业BL-M11D1临床试验,评价注射用BL-M11D1治疗复发/难治性急性髓系白血病安全性、耐受性、药代动力学特征和初步疗效的I期临床试验
试验目的
剂量递增阶段Ia(招募约26例,根据研究进展情况确定)主要目的
观察BL-M11D1在复发/难治性急性髓系白血病患者中的安全性和耐受性,从而确定BL-M11D1的最大耐受剂量(MTD)和剂量限制性毒性(DLT)。
剂量递增阶段Ia(招募约26例,根据研究进展情况确定)次要目的
1、评估BL-M11D1在复发/难治性急性髓系白血病患者中的药代动力学特征;
2、评估BL-M11D1在复发/难治性急性髓系白血病患者中的免疫原性。
剂量递增阶段Ia(招募约26例,根据研究进展情况确定)探索性目的
检测肿瘤细胞表面的CD33 蛋白表达,探索研究其与BL-M11D1有效性指标的相关性。
扩大入组阶段Ib(实际入组人数将根据疗效和安全性进行调整)主要目的
进一步观察BL-M11D1在Ia期推荐剂量下的安全性和耐受性,确定II期临床研究推荐剂量(RP2D)。
扩大入组阶段Ib(实际入组人数将根据疗效和安全性进行调整)次要目的
1、评估BL-M11D1在复发/难治性急性髓系白血病患者中的初步疗效;
2、进一步评估BL-M11D1在复发/难治性急性髓系白血病患者中的药代动力学特征;
3、评估BL-M11D1在复发/难治性急性髓系白血病患者中的免疫原性。
扩大入组阶段Ib(实际入组人数将根据疗效和安全性进行调整)探索性目的
根据Ia期的结果,进一步研究所选生物标志物与初步疗效相关性。
试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、自愿签署知情同意书,并遵循方案要求。
2、性别不限。
3、年龄:≥18岁且≤75岁。
4、预期生存时间≥3个月。
5、经病理组织学和/或细胞学确诊的复发/难治性急性髓系白血病(AML)。
6、形态学评估骨髓中原始细胞需≥5%。
7、体力状况评分ECOG ≤2分。
8、首次给药前外周血白细胞计数≤25×10^9/L。
9、既往抗肿瘤治疗的毒性已恢复至NCI-CTCAE v5.0定义的≤1级。
10、首次给药前7天内器官功能水平符合要求。
11、对于绝经前有生育可能的妇女必须在开始治疗之前的7天内做妊娠试验,血清/尿妊娠必须为阴性,必须为非哺乳期;所有入组患者(不管男性或女性)均应在整个治疗周期及治疗结束后6个月采取充分的屏障避孕措施。
排除标准
1、急性早幼粒细胞白血病、慢性髓系白血病急性变。
2、在首次给药前4周内或5个半衰期内使用过化疗、生物治疗、免疫治疗等抗肿瘤治疗。或姑息性放疗为首次给药前2周内。
3、筛选前6个月内严重心脏病病史。
4、QT间期延长、完全性左束支传导阻滞, III度房室传导阻滞,频发且不可控的心律失常。
5、活动性自身免疫性疾病和炎性疾病。
6、在首次给药前5年内诊断为其他恶性肿瘤。
7、控制不佳的高血压(收缩压>150mmHg或舒张压>100mmHg)。
8、根据CTCAE v5.0定义为≥3级的肺部疾病,有需要全身性类固醇治疗的ILD史,或现患间质性肺疾病。
9、存在中枢神经系统侵犯的患者。
10、对重组人源化抗体或人鼠嵌合抗体有过敏史或对BL-M11D1任何辅料成分过敏。
11、既往接受器官移植或异体造血干细胞移植术(Allo-HSCT)。
12、人类免疫缺陷病毒抗体阳性、活动性结核、活动性乙型肝炎病毒感染或活动性丙型肝炎病毒感染。
13、需全身性治疗的活动性感染,如重症肺炎、菌血症、败血症等。
14、存在有临床症状或需反复引流的胸腹盆腔积液或心包积液。
15、首次给药前4周或5个半衰期内曾参加另一项临床试验。
16、妊娠或哺乳女性。
17、研究者认为不适合采用参加本临床试验的其它情况。
