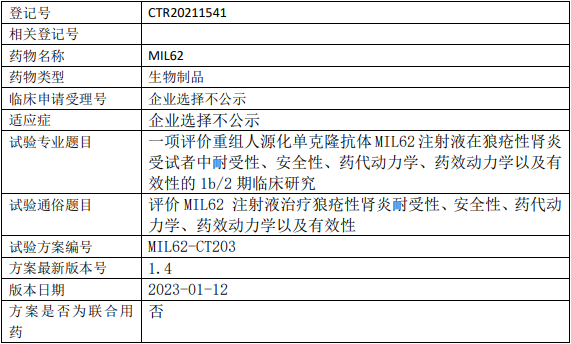
天广实/华放天实生物MIL62临床试验,评价重组人源化单克隆抗体MIL62注射液治疗狼疮性肾炎耐受性、安全性、药代动力学、药效动力学以及有效性的1b/2期临床试验
试验目的
1b期主要目的
评价不同剂量和给药频次的MIL62在狼疮性肾炎受试者中的耐受性,确定最大耐受剂量和2期临床研究剂量和给药频次。
2期主要目的
评价与比较MIL62联合标准疗法和安慰剂联合标准疗法治疗狼疮性肾炎76周的完全肾脏缓解率。
试验设计
试验分类:其他 其他说明:耐受性、安全性、药代动力学、药效动力学、有效性;生物样本检测单位:军科正源(北京)药物研究有限责任公司;中国,北京市
试验分期:其它 其他说明:1b/2期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至 74岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄≥18岁且<75岁,性别不限。
2、根据2019年欧洲抗风湿病联盟(EULAR)/美国风湿病学会(ACR)的诊断分类标准,诊断为系统性红斑狼疮(SLE)。
3、尿蛋白/肌酐比(UPCR)>1.0(24小时尿)。
4、如果患者正在服用潜在影响肾功能的药物(如ACE抑制剂、降胆固醇药物),则在入组前至少4周内和研究期间,剂量必须保持稳定。
5、无需在研究期间接种疫苗或在末次研究药物给药后至少16周后才需要接种疫苗的患者。
6、签署书面的知情同意书。
排除标准
1、筛选时合并有其它严重的肾脏疾病或状况,包括:
①需要透析或移植治疗;
②最近6个月内的肾活检结果表明,大于50%的肾小球硬化。
2、筛选时合并有以下疾病或状况:
①除了SLE以外,还患有其它自身免疫性疾病;
②有临床意义的出血高风险,或需要血浆置换或输血或输血小板的状况。
3、乙肝表面抗原(HBsAg)和/或乙肝核心抗体(HBcAb)阳性,且HBV DNA滴度超出正常值范围(HBsAg阳性或 HBcAb阳性患者需要定期HBV DNA检测,并接受抗病毒预防治疗);丙型肝炎病毒(HCV)抗体阳性且HCV RNA阳性的患者;人类免疫缺陷病毒(HIV)血清反应呈阳性;梅毒检查阳性。
4、妊娠期和哺乳期女性;对于未接受绝育手术的育龄女性:不同意在治疗期间和研究药物末次给药后至少18个月内,使用适当的方法避孕,如口服避孕药、宫内节育器或屏障避孕法联合杀精剂等。
5、对于未接受绝育手术的男性:不同意在本研究期间和研究药物末次给药后至少18个月内使用屏障避孕法,并不同意请求其配偶使用其它的方法避孕,如口服避孕药、宫内节育器、屏障法或杀精剂等。
6、研究者认为其它不适合参加本研究的情况。
