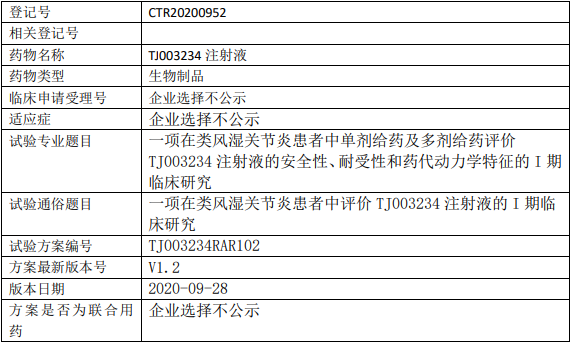
天境生物TJ003234临床试验,一项在类风湿关节炎患者中评价TJ003234注射液的I期临床研究
试验目的
主要目的
评价TJ003234注射液在RA患者中的安全性、耐受性。
次要目的
评价TJ003234注射液在RA患者中的药代动力学特征,评价TJ003234注射液在RA患者中的免疫原性;
其他目的
探索TJ003234的临床疗效及与疗效相关的生物标志物。
试验设计
试验分类:其他其他说明:安全性,耐受性和药代动力学特征
试验分期:I期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至70岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1.年龄:18~70周岁(含18和70周岁),性别不限。
2.根据2010年ACR/EULAR标准,在筛选前至少6个月被诊断患有类风湿关节炎
3.单剂:对全身28个关节进行压痛和肿胀数目的评估并进行DAS28评分≤3.2;多剂:对全身28个关节进行压痛和肿胀数目的评估并进行DAS28评分≤5.1且>3.2
4.允许接受一项或多项的标准治疗,但开始时间应不晚于随机前12周(84天),且在随机前4周(28天)内剂量稳定[随机前4周(28天)内不允许甲氨蝶呤(Methotrexate,MTX)和来氟米特联合治疗]
5.受试者愿意参与本研究,并且自愿签署知情同意书。
6.受试者(包括受试者的伴侣)在筛选期至给药后3个月内无妊娠计划且自愿采取避孕措施
排除标准
1.临床研究中心有潜在利益冲突的雇员或任何其他研究执行人员及其直系亲属
2.受试者存在既往和/或当前存在有临床意义且在入组前3个月尚未稳定的现有疾患,或急性疾病,计划医疗/手术流程,或于入组前2周内出现外伤,上述情形经研究者判断,认为参与研究可能会置受试者于相应风险中,或可能干扰研究药物评估或混淆研究结果解读,或影响患者自主参加研究的能力。
3.既往曾使用其他生物制剂(例如,阿达木单抗、依那西普、英夫利昔单抗等)或小分子靶向制剂(例如,托法替尼等)治疗类风湿关节炎的患者。
4.受试者在随机前28天内使用过以下非生物制剂类治疗RA的药物:他克莫司、环孢素、艾拉莫德、环磷酰胺、硫唑嘌呤、米诺环素、咪唑立宾、雷公藤、白芍总甙及其他中成药,中草药治疗类风湿关节炎的患者。
5.接受过下列任意一项内容:
1)当前或既往4周内使用过任何GM-CSF相关药物的;
2)在签署ICF的前2周(14天)内,使用过中成药、中草药、应急用(PRN)非处方类抗炎药物、及包括非甾体类抗炎药(NSAIDs)在内的外用药物进行治疗。
6.筛选前42天(6周)内,接受过下列任意一项:
1)肌肉注射过类固醇;
2)关节腔注射过类固醇;
3)静脉注射过类固醇。
7.存在除类风湿关节炎外的其他系统性炎症疾病(可能会影响结果的解释),包括但不限于:
1)系统性红斑狼疮;
2)脊柱关节病;
3)系统性血管炎;
4)痛风;
5)焦磷酸盐关节病。
8.肺部疾病:包括但不限于哮喘、慢性阻塞性肺疾病、肺间质病变、肺泡蛋白沉积症、肺肉芽肿病等,以及肺功能检查:用力肺活量(FVC)<80%预测值、或FEV1/FVC<70%,一氧化碳测定肺弥散量(DLCO)<80%等异常。
9.心血管疾病:近6个月有急性心肌梗死或者不稳定性心绞痛、严重心律失常(多源频发室早、室速、室颤)等病史;纽约心功能分级(NYHA)III级-IV级。
10.在过去5年内存在恶性肿瘤史(无论治疗与否),但除外经成功治疗的皮肤基底细胞或鳞状细胞癌。
11.其它未控制的疾病:临床上明显不稳定或未得到有效控制的、与RA无关的急性或慢性疾病(如急性肺炎、肺动脉高压、糖尿病酮症酸中毒、急性胰腺炎等),经研究者判定,可能混淆研究结果或置受试者于不适当的危险之中。
12.感染:受试者筛选期存在任何急性、慢性的或复发性感染(如肺结核、肺囊虫、巨细胞病毒、单纯疱疹病毒、带状疱疹、非典型分枝杆菌感染,以及复发性鼻窦炎、生殖器疱疹、带状疱疹、骨髓炎及尿路感染等)。
13.结核分枝杆菌感染者,包括“T-SPOT”或“QuantiFERON法”检测结果阳性的潜伏性感染者。
14.乙肝表面抗原(HBsAg),乙肝核心抗体(HBcAb),丙肝病毒抗体(HCVAb),人类免疫缺陷病毒抗体(HIVAb),梅毒螺旋体抗体(TPPA法)检测任意一项阳性者。除外乙肝核心抗体(HBcAb)检测呈阳性,但乙肝DNA检测确认不在乙肝活动期的受试者(HBV-DNA高于检测下限者排除)。
15.肝肾功能异常:
天冬氨酸转氨酶(AST)或丙氨酸转氨酶(ALT)或谷氨酰转肽酶(GGT)检测值大于正常值上限(ULN)的2倍;
或者碱性磷酸酶(ALP)或总胆红素检测值大于正常值上限(ULN)的1.5倍;
或肌酐(Cr)或尿素氮(BUN)检测值大于正常值上限(ULN)的1.5倍;
或筛选前eGFR≤60ml/min。eGFR计算采用MDRD公式:eGFR(ml/min×1.73m2)=186×血肌酐(Scr)-1.154×年龄-0.203×性别(若受试者为女性则乘0.742,若受试者为男性则乘1)。
16.血液系统疾病或血常规检查异常:既往或正在罹患血液系统疾病受试者(包括但不限于:骨髓纤维化、再生障碍性贫血、白血病、淋巴瘤等),血常规检查血红蛋白<90g/L、白细胞<4×109/L、中性粒细胞<2.5×109/L、淋巴细胞<1.1×109/L、血小板<80×109/L。
17.手术或其它情况:计划进行手术或有任何其它疾病史(例如,近期败血症病史)、实验室检查异常或其它情况,经研究者判定不适合参加本研究。
18.移植:有重要器官移植(例如,心脏、肺、肾脏、肝脏)或造血干细胞/骨髓移植史。
19.妊娠或哺乳期女性。
20.入选前3个月参加过任何临床试验(包括研究性疫苗)治疗或曾使用侵入性的研究性医疗器械,或现正在入组某项干预性调查研究。
21.筛选前30天内曾接受疫苗接种。
22.通过尿药筛查发现药物滥用者,筛查药物包括吗啡、氯胺酮、四氢大麻酚酸、甲基安非他明、二亚甲基双氧安非他明。
23.通过询问病史发现筛选前3个月内饮酒量超过14个单位的酒精/周(1个单位酒精=啤酒360mL、葡萄酒150mL或白酒45mL),或试验期间不能禁酒者。
24.研究者认为受试者不适合参与此项临床研究。根据研究者的意见,任何可能会增加受试者参加研究相关的风险、或者可能干扰研究药物评估或混淆研究结果解读的任何情况。
研究者信息
主要研究者
姓名:栗占国
学位:医学
博士职称:主任医师
单位名称:北京大学人民医院
各参加机构
| 序号 | 机构名称 | 主要研究者 | 地址 |
| 1 | 北京大学人民医院 | 栗占国 | 北京市西城区西直门南大街11号 |
| 2 | 南京大学附属鼓楼医院 | 李娟 | 江苏省南京市鼓楼区中山路321号 |
| 3 | 蚌埠医学院第一附属医院 | 李志军 | 安徽省蚌埠市龙子湖区长淮路287号 |
| 4 | 复旦大学附属华山医院 | 薛愉 | 上海市静安区乌鲁木齐中路12号 |
| 5 | 东南大学附属中大医院 | 王美美 | 江苏省南京市鼓楼区丁家桥87号 |
| 6 | 内蒙古医科大学附属医院 | 王勇/郭智 | 内蒙古自治区呼和浩特市回民区通道北街1号 |
| 7 | 郑州大学第一附属医院 | 刘升云 | 河南省郑州市二七区建设东路1号 |
| 8 | 苏州大学医学院第一附属医院 | 武剑/缪丽燕 | 江苏省苏州市姑苏区平海路899号 |
| 9 | 烟台毓璜顶医院 | 汤艳春 | 山东省烟台市芝罘区毓璜顶东路20号 |
| 10 | 山西医科大学第一医院 | 傅自力 | 山西省太原市迎泽区解放南路85号 |
| 11 | 华中科技大学同济医学院附属协和医院 | 黄安斌 | 湖北省武汉市江汉区解放大道1277号 |
| 12 | 首都医科大学附属北京友谊医院 | 刘燕鹰 | 北京市西城区永安路95号 |
