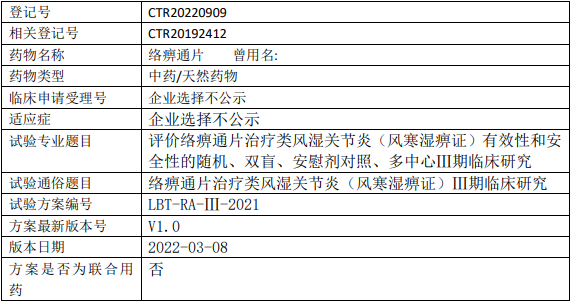
以岭药业络痹通片临床试验,评价络痹通片治疗类风湿关节炎(风寒湿痹证)有效性和安全性的随机、双盲、安慰剂对照、多中心Ⅲ期临床试验
试验目的
1、确证络痹通片治疗中、重度活动性类风湿关节炎(风寒湿痹证)的有效性。
2、进一步评价络痹通片临床应用的安全性。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至70岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄在18周岁至70周岁(含两端),男女不限。
2、筛选时符合西医类风湿关节炎诊断标准(1987年美国风湿病学会类风湿关节炎分类标准)。
3、筛选时符合中医风寒湿痹证辨证标准。
4、筛选时符合中度或重度活动性类风湿关节炎(DAS28-ESR>3.2或DAS28-CRP>3.2)诊断,且C反应蛋白或红细胞沉降率大于正常值上限。
5、筛选时关节功能在Ⅰ~Ⅲ级,X线分期在Ⅰ~Ⅲ期。
6、筛选时已接受甲氨蝶呤(MTX)治疗,用药时间至少为12周,且保持剂量稳定(7.5~20mg/周)4周。
7、筛选时如合并使用泼尼松(龙)(≤10mg/d)或等量激素治疗的患者进入研究前剂量稳定至少4周并且在以后的治疗中不增加。如果未用激素,则在开始治疗前短效和中效激素至少已1周未用,长效激素至少已2周未用。
8、筛选时如合并使用非甾体抗炎药物(NSAIDs),则剂量至少已稳定4周,如未服用,则至少已1周未服。
9、自愿签署知情同意书。
排除标准
1、重叠严重的自身免疫性疾病。
2、类风湿关节炎晚期畸形、残废、丧失劳动力者。
3、对试验用药物(包括基础药物和急救药物)过敏,或过敏体质。
4、胸部X线检查提示有活动性肺部感染者。
5、乙肝表面抗原、丙肝抗体检查阳性、HIV抗体阳性或有获得性免疫缺陷综合症(AIDS)病史。
6、妊娠和哺乳期妇女,或育龄女性妊娠试验阳性者,或研究期间及最后一次给药后6个月内有生育要求者。
7、存在任何不稳定的心血管疾病(包括纽约心脏病学会NYHA心功能分级达Ⅲ或Ⅳ级、充血性心力衰竭、不稳定性心绞痛、一年内心肌梗塞病史),存在可导致QTc延长或心律失常的因素如充血性心力衰竭、低钾血症、先天性长QT综合征,长QT综合征的家族史,其他已知可延长QT间期的合并用药。
8、有证据显示受试者患有严重、进行性、未控制的脑血管疾病、造血、内分泌(包括糖尿病)、呼吸(包括间质性肺炎和肺纤维化)等严重原发性疾病和精神类疾病的患者。研究者认为参加本研究会使受试者置于不可接受的风险中。
9、有恶性肿瘤病史者。
10、在试验用药开始前7天内,实验室检查:
(1)血常规:血白细胞<3.0×109/L,血小板<90×109/L,血红蛋白<85g/L;
(2)肝功能:天冬氨酸氨基转移酶或丙氨酸氨基转移酶>1.5×ULN;
(3)肾功能:血肌酐(Scr)>ULN;
(4)心肌酶:肌酸激酶、乳酸脱氢酶或肌酸激酶同工酶>1.5×ULN。
11、入组前4周内接受过除MTX之外的改善病情抗风湿药物(DMARDs)(如柳氮磺吡啶、羟氯喹、D-青霉胺、硫唑嘌呤、环孢菌素、环磷酰胺、雷公藤制剂)治疗。
12、入组前1周内接受过艾拉莫德治疗。
13、入组前2周内使用过其他治疗类风湿关节炎的中药。
14、入组前12周内接受过来氟米特治疗(如已接受标准的消胆胺洗脱治疗(消胆胺8g口服,3次/日,连续服用11日),则在入组前停药至少4周即可纳入)。
15、入组前24周内使用过生物制剂(包括肿瘤坏死因子(TNF)α-拮抗剂(如依那西普,英夫利西单抗和阿达木单抗)、白细胞介素(IL)-l和IL-6拮抗剂等)的患者。
16、有酒精、药物滥用病史者。
17、研究者认为其他原因不宜参加本试验者。
18、在筛选前3个月内参加其他临床研究者。
