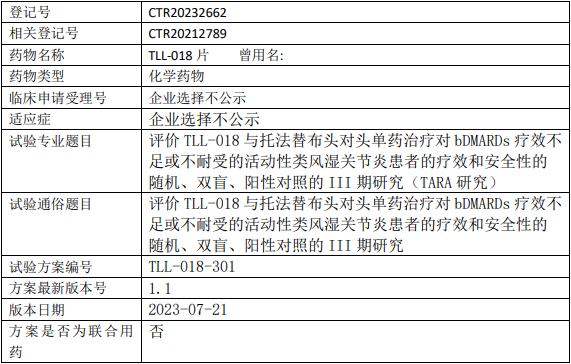
高光制药TLL-018临床试验,评价TLL-018片与托法替布头对头单药治疗对bDMARDs疗效不足或不耐受的活动性类风湿关节炎疗效和安全性的III期临床试验
试验目的
第一阶段目的
1、评估TLL-018与托法替布在治疗bDMARDs疗效不足或不耐受的活动性类风湿关节炎患者中的疗效;
2、评价TLL-018治疗bDMARDs疗效不足或不耐受的活动性类风湿关节炎患者的安全性;
3、分析TLL-018的药代动力学特征。
第二阶段目的
评价TLL-018长期治疗bDMARDs疗效不足或不耐受的活动性类风湿关节炎患者的安全性和疗效。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至65岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄在18-65岁(包含上下限);
2、符合美国风湿病协会/欧洲抗风湿联盟(ACR/EULAR,2010)的类风湿关节炎诊断标准,在筛选访视时病程至少3个月;
3、受试者符合以下标准的活动性类风湿关节炎:在筛选期,须满足高敏C反应蛋白(hsCRP)≥5mg/L(中心实验室)或血沉(ESR)≥28 mm/h;且:
①6个或以上关节肿胀(SJC)(66个关节计数);
②6个或以上关节活动时触痛或疼痛(TJC)(68个关节计数);
③进行过重大手术治疗及随机前4周内接受过关节腔注射治疗的关节不纳入SJC和TJC计数。
4、受试者既往必须接受过至少一种bDMARDs不耐受,或至少一种bDMARDs治疗≥3个月且疗效不足;
5、符合ACR(1991)的Ⅰ、Ⅱ或Ⅲ级的关节功能分级标准;
6、为了维持稳定的医疗状态,允许口服使用稳定剂量的糖皮质激素(剂量≤强的松10mg/天或等当量其他激素)、允许使用稳定剂量的非甾体抗炎药(NSAIDs) ,但均必须在随机前维持稳定剂量≥1周;
7、筛选时体重指数[BMI=体重(kg)/身高2(m2)]≤35kg/m2;
8、有生育可能的女性受试者(WOCBP),不应处于孕期或哺乳期,妊娠检测(如基于HCGβ亚单位的监测)后方可进入研究(需记录末次月经);
9、所有受试者以及他们的伴侣在试验用药品首次给药至末次给药后至少90天内自愿采取研究者认为有效的避孕措施;受试者在筛选期至末次用药后至少6个月内无捐精、捐卵计划;
10、受试者理解知情同意书且自愿参加研究,并签署知情同意书;知情同意书的签署时间必须先于任何试验流程。
排除标准
1、受试者符合美国风湿病协会/欧洲抗风湿联盟(ACR/EULAR,2010)的类风湿关节炎诊断标准但同时伴随以下疾病的不能入组:
●当前伴随诊断为其他风湿性疾病如系统性红斑狼疮、银屑病、混合性结缔组织病等(继发性干燥综合征除外);
●当前伴随诊断为其他系统性炎症性疾病,包括但不限于幼年慢性关节炎、炎症性肠病、皮肌炎、多肌炎、硬皮病、活动性血管炎(静脉类风湿结节除外)、脊柱关节病、强直性脊柱炎、银屑病关节炎等;
●伴有纤维肌痛(目前症状活跃),根据研究者认为会影响RA活动性判断;
●伴有进展的或不可控制的肾脏、肝脏、血液、胃肠、内分泌、肺、心血管、神经、精神或脑疾病症状;
●研究者认为参加本研究会使受试者置于不可接受的风险中。
2、受试者既往治疗或伴随用药出现如下情况不能入组:
1)随机前4周内接受过治疗类风湿性关节炎的植物药制剂(如雷公藤、白芍总苷、青藤碱等)或中药/中成药;
2)随机前4周内接受过干扰素治疗,包括I型重组干扰素(如罗扰素、甘乐能、佩乐能、倍泰龙、干复津、派罗欣、安达芬、迪恩安、福康泰)和II型重组干扰素(如Actimmune)等;
3)随机前4周内(或少于5个消除半衰期内)接受任何试验用药品者(选时间最长者);
4)随机前8周内使用来氟米特,除外使用消胆胺(8g TID)或者活性炭(50g QID)洗脱≥11天者可入组;
5)随机前4周内使用强效阿片类药物,包括(但不限于):羟考酮、羟吗啡酮、芬太尼、左啡诺、丁丙诺啡、美沙酮、氢吗啡酮和吗啡;
6)在基线疗效评估访视前24小时临时(非长期固定剂量)服用非甾体抗炎药(NSAIDs)、扑热息痛、曲马多、可待因、氢可酮和丙氧酚等。
3、随机前4周内关节内注射糖皮质激素关节数超过2个;
4、随机前4周内经历过重大手术,或预期在入组后接受重大手术治疗;
5、随机前2个月内接种过任何活疫苗者,或在研究期间计划接种活疫苗者;
6、筛选期实验室检查值异常且有临床意义
7、随机前3个月内参加献血且献血总量≥400mL,或接受输血者;
8、已知对托法替布、TLL-018及这两种药物的任何辅料的药物成分过敏;
9、不能完成研究相关评估者。
