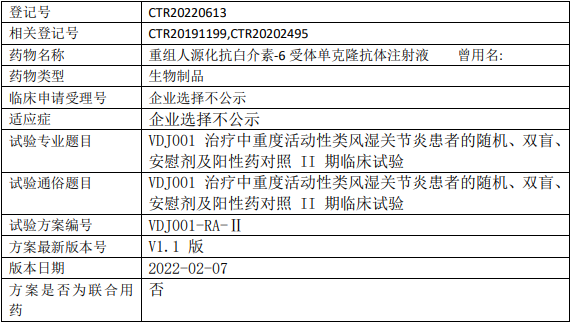
伟德杰VDJ001临床试验,重组人源化抗白介素-6受体单克隆抗体注射液VDJ001治疗中重度活动性类风湿关节炎的II期临床试验
试验目的
以阳性药托珠单抗和安慰剂为对照,评价重组人源化抗白介素-6受体单克隆抗体注射液在中重度活动性类风湿关节炎(RA)患者中的初步疗效及剂量与疗效之间的关系。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1.自愿签署知情同意书;
2.年龄18~75周岁(含边界值);
3.采用1987年美国风湿病学会(ACR)标准或2010年ACR和欧洲抗风湿病联盟(EULAR)分类标准诊断为RA;
4.筛选时根据以下标准判断为中、重度活动性RA:关节肿胀个数≥6(基于66个关节)且关节压痛个数≥6(基于68个关节),同时必须满足C反应蛋白(CRP)≥10mg/L或红细胞沉降率(ESR)≥28mm/h;
5.随机化前已经接受甲氨蝶呤(MTX)口服治疗至少12周且稳定剂量(MTX剂量为7.5-25mg/周)至少4周;MTX肠道外用药史(皮下、肌内或静脉注射)的受试者有资格入选研究,但在随机化前,这些受试者必须已经接受≥4周的MTX7.5-25mg/周稳定剂量口服治疗;
6.筛选时,如果受试者正在服用强的松或相当剂量的糖皮质激素,则随机化前稳定剂量(强的松剂量≤10mg/天)治疗至少4周。
排除标准
1.体重>100kg或<40kg。2.ACR功能分级为IV级或长期卧床/久坐轮椅者。
3.过敏体质或已知对研究治疗的任何成分和/或其他同类产品过敏者。
4.研究者判定受试者曾接受过的手术或者计划接受的手术可能会影响对评估关节的研究评价。
5.患有除类风湿关节炎外的风湿免疫性疾病,未控制的需要口服皮质类固醇治疗的免疫系统疾病,研究者认为影响试验评价者。6.原发性或继发性免疫缺陷病(既往或目前为活动性)。
7.既往或目前患有肿瘤。
8.患有任何淋巴增殖性疾病病史者,如EBV相关淋巴增殖性疾病、淋巴瘤、白血病、骨髓增生性疾病、多发性骨髓瘤的病史,或提示当前有淋巴疾病的体征和症状。
9.存在严重的、控制不佳的伴随疾病,例如(但不限于)神经系统、心血管、肝、肾、胃肠道、内分泌疾病,并且经研究者判断可能会妨碍受试者参加本研究。
10.患有任何可能影响本研究疗效评估的先天性或获得性神经系统疾病、血管疾病或系统性疾病,尤其是关节疼痛和肿胀(例如帕金森病、脑瘫、糖尿病性神经病变)。
11.已知有以下感染:复发性活动性细菌、病毒、真菌、分枝杆菌或其他感染(包括但不限于结核病和非典型分支杆菌病、胸部X线检查发现肉芽肿病、丙型肝炎病毒感染、HIV感染以及带状疱疹,但不包括甲床真菌感染),或筛选前6个月有慢性感染史,或存在需要在筛选前4周内住院治疗或抗生素静脉治疗或在筛选前2周内抗生素口服治疗的任何感染大发作,或有结核病史者;对于结核筛查阳性者,经预防性治疗后,可由研究者判断是否入组。
12.在筛选访视前4周内接受活疫苗/减毒疫苗/新冠病毒灭活疫苗的受试者或已知在12周治疗观察期内会接受活疫苗/减毒疫苗/新冠病毒灭活疫苗的受试者。
13.筛选前使用过或计划在研究期间使用淋巴细胞耗竭剂/疗法、烷化剂、全淋巴照射等治疗方式者。
14.既往曾接受过IL-6和IL-6R抑制剂治疗。
15.在以下时间内使用生物类DMARDs:
a)阿那白滞素、依那西普:给药前28天内;
b)阿达木单抗、英夫利西单抗:给药前56天内;
c)戈利木单抗、赛妥珠单抗:给药前70天内;
d)阿巴西普:给药前84天内;
e)狄诺塞麦:给药前150天内;
f)利妥昔单抗:给药前180天内。
16.在给药前28天内使用除MTX外的非生物类DMARDs(不含氯喹、羟氯喹,给药前56天内使用来氟米特,或者采用标准考来烯胺治疗后或活性碳洗脱后不超过28天的受试者不得入选试验)。
17.在给药前28天内接受过关节内或肠道外皮质类固醇治疗。
18.在给药前56天内使用过金诺芬、金硫代葡萄糖(注射用金)、金硫代苹果酸盐(注射用金)或口服脊髓灰质炎疫苗免疫者。
19.筛选前24周内静脉注射丙种球蛋白,进行血浆置换或使用prosorba柱者。
20.筛选前1个月或其他试验药物5个半衰期(以时间较长者为准)内参加过其他药物临床研究。
21.乙肝表面抗原(HBsAg)阳性,或乙肝两对半中如果乙肝核心抗体(HBcAb)阳性则加查HBVDNA且HBVDNA>检测下限者。
22.实验室检查值(允许复测一次,且以最后一次检查结果为准)满足以下任一条件者:
1)血清肌酐:女性受试者血清肌酐>1.4mg/dL(124μmol/L);男性受试者血清肌酐>1.6mg/dL(141μmol/L);
2)ALT或AST>正常值上限(ULN)的1.5倍;
3)血小板计数<80×109/L;4)WBC<3.5×109/L;5)总胆红素>ULN的1.5倍。
23.妊娠期、或哺乳期、或筛选期妊娠试验阳性的女性受试者,或自筛选期至完成或终止试验后6个月不能采取有效避孕措施的受试者(包括男性受试者及其女性配偶)。
24.研究者判断其他不符合入组的受试者。
研究者信息
主要研究者
姓名:栗占国
学位:医学博士
职称:教授
单位名称:北京大学人民医院
各参加机构
| 序号 | 机构名称 | (主要)研究着 | 地址 |
| 1 | 北京大学人民医院 | 栗占国 | 北京市西城区西直门南大街11号 |
| 2 | 新疆维吾尔族自治区人民医院 | 武丽君 | 新疆乌鲁木齐市天山区天池路91号 |
| 3 | 北京医院 | 张烜 | 北京市东城区东单大华路1号 |
| 4 | 山东大学齐鲁医院 | 刘花香 | 山东省济南市历下区文化西路107号 |
| 5 | 南京大学医学院附属鼓楼医院 | 孙凌云 | 江苏省南京市中山路321号 |
| 6 | 蚌埠医学院第一附属医院 | 李志军 | 安徽省蚌埠市龙子湖区长淮路287号 |
| 7 | 萍乡市人民医院 | 胡建康 | 江西省萍乡市安源区武功山中大道8号 |
| 8 | 川北医学院附属医院 | 袁国华 | 四川省南充市顺庆区文化路63号 |
| 9 | 常州市第一人民医院 | 吴敏 | 江苏省常州市天宁区局前街185号 |
| 10 | 济南市第四人民医院 | 王晖 | 山东省济南市天桥区师范路50号 |
| 11 | 枣庄市立医院 | 张华 | 山东省枣庄市市中区龙头中路41号 |
| 12 | 郑州大学第一附属医院 | 刘升云 | 河南省郑州市二七区建设东路1号 |
| 13 | 北京大学深圳医院 | 王庆文 | 广东省深圳市福田区莲花路1120号 |
| 14 | 吉林省人民医院 | 陈琳 | 吉林省长春市朝阳区工农大街1183号 |
| 15 | 濮阳市油田总医院 | 李凤菊 | 河南省濮阳市华龙区大庆路124号 |
| 16 | 宝鸡市中心医院 | 张引索 | 陕西省宝鸡市渭滨区姜谭路8号 |
