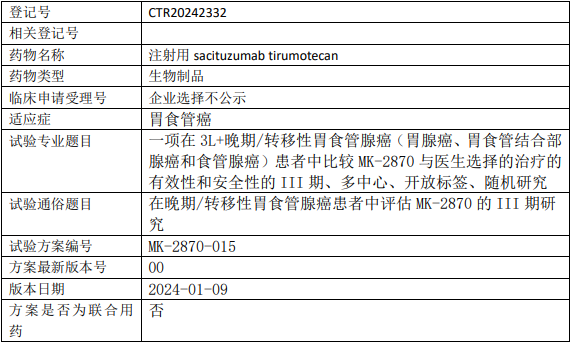
默沙东MK2870临床试验,比较MK-2870(注射用SacituzumabTirumotecan)与医生选择的治疗3L+晚期/转移性胃食管腺癌(胃腺癌、胃食管结合部腺癌和食管腺癌)有效性和安全性的III期临床试验
试验目的
在3L+晚期或转移性胃、胃食管结合部或食管腺癌受试者中比较MK-2870 TROP2ADC单药治疗与医生选择的治疗的有效性、安全性和耐受性。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:开放
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1.经组织学或细胞学确诊为晚期、不可切除或转移性胃腺癌、胃食管结合部腺癌或食管腺癌。
2.既往接受过至少2种化疗和/或免疫治疗方案,并在治疗期间发生疾病进展。
3.研究可入组任何HER2状态的受试者。如果HER2状态未知,研究中心应根据当地标准确定是否需要将HER2检测作为SOC。HER2+受试者既往必须接受过曲妥珠单抗治疗(如有/如适用)。
4.有充足的器官功能。
5.已提供存档肿瘤组织样本或最近一次获得的(既往未接受过放疗的)肿瘤病灶粗针、切取或切除活检样本。
6.因既往抗肿瘤治疗而发生AE的受试者必须已恢复至≤1级或基线水平。发生内分泌相关AE且接受激素替代治疗充分的受试者有资格参加研究。
7.有由当地研究中心研究者/影像科医师根据RECIST1.1评估的可测量病灶。
8.随机分组前3天内ECOG体能状态为0或1分。
9.对于可能接受曲氟尿苷-替匹嘧啶治疗的患者,必须能够吞咽口服药物。
排除标准
1.研究干预首次给药前3个月内体重减轻20%以上。
2、有记录的重度干眼症、重度睑板腺疾病和/或睑缘炎或妨碍/延缓角膜愈合的角膜疾病史。
3、有≥2级周围神经病变。
4、患有需要免疫抑制药物治疗的活动性炎症性肠病,或有炎症性肠病既往史(例如,克罗恩病、溃疡性结肠炎或慢性腹泻)。
5、在研究干预首次给药前6个月内患有未受控的重大心血管疾病或脑血管疾病。
6、既往接受过TROP2靶向ADC、含拓扑异构酶1抑制剂的ADC和/或含拓扑异构酶1抑制剂的化疗。
7、患有正在发生进展或过去3年内需要积极治疗的已知其他恶性肿瘤。
8、活动性乙型肝炎(定义为HBsAg有反应性和/或可检出HBVDNA)和/或丙型肝炎病毒(定义为抗HCVAb阳性和可检出HCVRNA)感染或已知有乙型肝炎和/或丙型肝炎感染史。
9、在研究干预首次给药前30天内接种过活疫苗或减毒活疫苗。
10、目前正在接受强效和/或中效CYP3A4诱导剂/抑制剂治疗,且在研究期间无法停用。
11、已知有活动性的CNS转移和/或癌性脑膜炎。
12、对MK-2870、其任何辅料和/或其他生物疗法有重度超敏反应(≥3级)。
