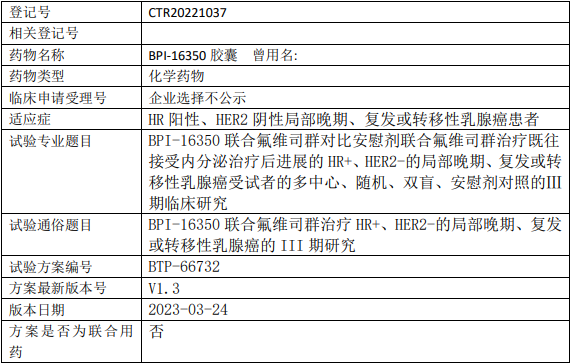
贝达药业BPI-16350临床试验,BPI-16350(酒石酸泰贝西利胶囊)联合氟维司群对比安慰剂联合氟维司群治疗既往接受内分泌治疗后进展的HR+、HER2-的局部晚期、复发或转移性乳腺癌的III期临床试验
试验目的
主要目的
评估在既往接受内分泌治疗后进展的HR+/HER2-的晚期乳腺癌受试者中,与安慰剂联合氟维司群相比,BPI-16350胶囊联合氟维司群治疗的有效性。
次要目的
1、评估BPI-16350胶囊联合氟维司群对比安慰剂联合氟维司群在接受内分泌治疗后进展的HR+/HER2-的晚期乳腺癌受试者中的安全性;
2、评估药物的群体药代动力学特性,并探索药物暴露与疗效、安全性的关系;
3、评估BPI-16350胶囊联合氟维司群对比安慰剂联合氟维司群对受试者健康相关生活质量的影响。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18周(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄≥18周岁的受试者。
2、组织学或细胞学上确诊为HR+/HER2-,局部晚期、复发或转移性乳腺癌,不适合以治愈为目的的手术切除或放射治疗,且无进行化疗的临床指征。
3、允许针对晚期复发/转移性疾病不超过一线的化疗。
4、既往接受内分泌治疗后进展者。
5、自然绝经状态,或既往进行过双侧卵巢切除术,或药物去势达到绝经后状态的女性受试者。
6、依据RECIST v1.1定义,至少存在1个可测量病灶或仅存在不可测量的骨病灶。
7、预期生存期≥12周。
8、ECOG评分0~1。
9、有足够器官功能。
10、既往抗肿瘤治疗或外科手术的所有急性毒性反应缓解至基线严重程度或NCI-CTCAE v5.0 ≤1级。
排除标准
1、使用研究药物前28天内使用过细胞毒性药物;使用研究药物前14天内曾接受过内分泌或小分子药物酪氨酸激酶抑制剂TKI治疗的受试者。
2、既往接受过氟维司群和/或依维莫司治疗;以及接受过其他CDK4/6抑制剂的治疗。
3、病理诊断为HER2阳性。
4、研究者判断不适合内分泌治疗的受试者。
5、活动性乙型肝炎,活动性丙型肝炎(HCV),有临床意义的梅毒阳性患者和人类免疫缺陷病毒(HIV)抗体阳性患者。
6、接受过自体或同种异体器官或干细胞移植手术;在首次用药前4周内进行过大手术或严重外伤的受试者。
7、临床怀疑或确认的脑实质、脑膜、脊髓转移者。
8、首次用药前6个月内有发生动/静脉血栓事件或有任何不稳定的系统性疾病。
9、过去5年内曾患有其他恶性肿瘤,但已治愈的皮肤基底细胞癌、皮肤鳞状细胞癌和宫颈原位癌不影响入组。
10、给药前1周内接受过中效或强效的CYP3A抑制剂或诱导剂或接受过CYP2C19的高度敏感底物或中药抗肿瘤治疗者。
11、间质性肺疾病或肺纤维化。
12、研究者认为不适合参加本试验的其他情况。
