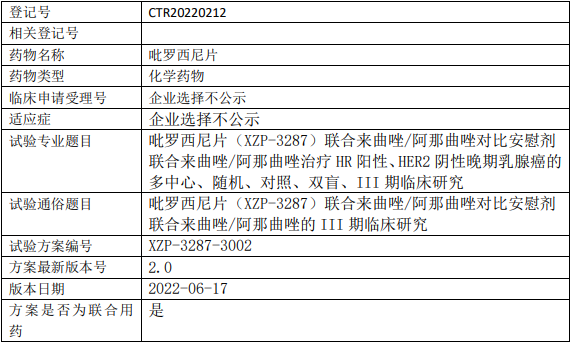
轩竹生物吡罗西尼临床试验,吡罗西尼片(XZP-3287)联合来曲唑/阿那曲唑对比安慰剂联合来曲唑/阿那曲唑治疗HR阳性、HER2阴性晚期乳腺癌的III期临床试验
试验目的
主要目的
比较吡罗西尼片联合来曲唑/阿那曲唑与安慰剂联合来曲唑/阿那曲唑治疗HR阳性、HER2阴性的局部晚期、复发或转移性乳腺癌受试者的有效性。
次要目的
比较吡罗西尼片联合来曲唑/阿那曲唑与安慰剂联合来曲唑/阿那曲唑治疗HR阳性、HER2阴性的局部晚期、复发或转移性乳腺癌受试者的有效性、安全性以及群体药代动力学特征。
探索性目的
评估吡罗西尼片联合来曲唑/阿那曲唑对比安慰剂联合来曲唑/阿那曲唑治疗后受试者疾病或治疗相关症状的患者报告结果(PRO),包括生活质量评分和健康状态评分。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:女
健康受试者:无
出入排标准
入选标准
1、年龄≥18周岁且≤75周岁的女性受试者;
2、受试者处于绝经状态;
3、组织学或细胞学确诊的局部晚期、复发或转移性乳腺癌,病理证实为HR阳性、HER2阴性;
4、存在局部晚期、复发或转移的证据,不适合以治愈为目的的手术切除或放射治疗,且无必须进行化疗的临床指征;
5、既往未曾接受过任何针对局部晚期疾病、复发或转移性疾病的系统性抗癌治疗的受试者(若受试者在签署知情同意书前接受了≤14天的芳香化酶抑制剂治疗,并同意在签署知情同意书前停止芳香化酶抑制剂的治疗,则可纳入本研究),需满足以下标准之一;
A)初诊为不可手术的局部晚期或转移性乳腺癌;
B)根治术后未接受过辅助内分泌治疗的复发或转移性乳腺癌;
C)完成辅助内分泌治疗,停药后大于12个月进展;
D)接受辅助内分泌治疗(如TAM,来曲唑或阿那曲唑除外)2年后,影像学证实的疾病复发或转移性乳腺癌;
6、受试者必须具有至少一处符合RECISTv1.1定义的可测量病灶或者仅有骨转移病灶;
7、ECOG评分为0~1分;
8、经基线检查证实有足够的骨髓和器官功能;
9、育龄期女性受试者必须随机前7天内进行血清妊娠试验,且结果为阴性;受试者愿意在研究期间和末次给予研究药物治疗后6个月内采用一种经医学认可的高效避孕措施;
10、既往抗肿瘤治疗或外科手术所致的所有急性毒性反应缓解至0~1级(NCI-CTCAEv5.0),或者至入组标准所规定的分级(脱发等对受试者无安全风险的其它毒性除外);
11、受试者充分知情,并自愿签署知情同意书。
排除标准
1、弥漫肝转移或50%以上肝脏受累,或存在内脏危象、炎性乳腺癌、癌性淋巴管炎、脑转移、脑膜转移的受试者,允许稳定的脑转移受试者入组;
2、随机前4周内存在有临床意义的胸腔积液、腹腔积液、心包积液;
3、仅皮肤病灶作为唯一靶病灶的受试者;
4、既往接受过mTOR抑制剂(如依维莫司)或CDK4/6抑制剂治疗;
5、随机前4周内进行过大手术、化疗、放疗或其他抗肿瘤治疗(如口服芳香化酶抑制剂参见入选标准5);
6、随机前14天内参加了其他临床试验或在试验药物的5个半衰期内,以时间较长者为准;
7、随机前14天内使用了CYP3A4强效抑制剂或强效诱导剂或在药物的5个半衰期内,以时间较长者为准;
8、随机前7天内开始使用双膦酸盐或RANKL抑制剂,研究随机前>7天已开始治疗的受试者不应改变使用方法;
9、随机前5年内曾诊断为任何其它恶性肿瘤,但既往已治愈的任何类型原位癌、微小或低危甲状腺乳头状癌以及痊愈的皮肤基底细胞癌或鳞状皮肤细胞癌等除外;
10、受试者处于乙肝或丙肝活动期,或人免疫缺陷病毒(HIV)抗体阳性;
11、随机前4周内合并重度感染,或在筛选期间/随机前出现不明原因的发热>38.3℃;
12、随机前6个月内存在心脏功能受损或具有临床意义的心脏疾病;
13、随机前6个月内出现脑血管意外,包括短暂性脑缺血发作或者脑卒中病史;肺栓塞;
14、无法吞咽、肠梗阻或存在影响药物服用和吸收的其他因素;
15、已知对本方案试验药物组分有过敏史者;
16、已知有自体或异体造血干细胞移植史;
17、已知有精神类药物滥用或吸毒史;
18、哺乳期女性;
19、研究者认为不适合参加本研究的其他情况。
20、随机前14天内使用了具有免疫调节作用或抗肿瘤作用的中药;
