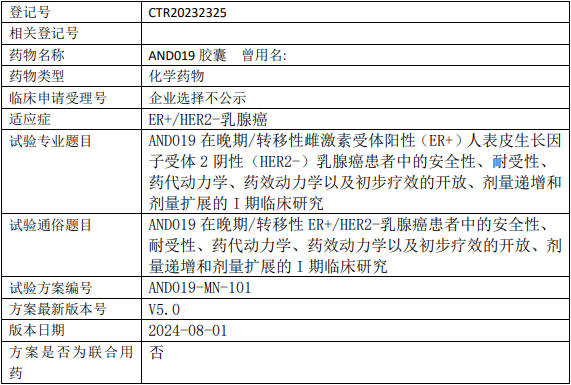
安道药业AND019临床试验,AND019胶囊治疗晚期/转移性雌激素受体阳性(ER+)人表皮生长因子受体2阴性(HER2-)乳腺癌安全性、耐受性、药代动力学、药效动力学以及初步疗效的I期临床试验
试验目的
主要目的
1、评估AND019在ER+/HER2-乳腺癌受试者中的安全性和耐受性;
2、评估AND019在ER+/HER2-乳腺癌受试者中的药代动力学特征。
次要目的
1、确定AND019在ER+/HER2-乳腺癌受试者中的二期推荐剂量(Recommended Phase 2 Dose,RP2D);
2、评估AND019在ER+/HER2-乳腺癌受试者中的初步疗效。
探索性目的
1、评估AND019在ER+/HER2-乳腺癌受试者中的无进展生存期(Progression Free Survival,PFS);
2、初步评估治疗前和治疗后肿瘤组织和外周血中与疗效及耐药相关的药效动力学(Pharmaco Dynamics,PD)/生物标志物。
试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国际多中心试验
3、受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:女
健康受试者:无
出入排标准
入选标准
1、自愿参加临床研究并签署书面知情同意书。
2、18周岁及以上(以签署书面知情同意书的时间为准)的绝经后女性受试者;或对于使用药物致卵巢功能抑制(OFS)的女性受试者。具体详见方案定义。
3、经组织学或细胞学确诊的晚期/转移性ER+/HER2-的乳腺癌,具体详见方案定义。
4、既往化疗和激素治疗满足方案规定。
5、美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分0-1分。
6、基于RECIST v1.1标准下的可评估疾病;对于知情同意组织活检的受试者,疾病情况应适于进行肿瘤活检。
7、由研究者判断预计生存时间不少于3个月。
8、骨髓储备和器官的功能水平满足方案规定。
排除标准
1.已知对AND019胶囊或AND019·MSA胶囊或其任何辅料成分过敏或同类药过敏,或过敏体质者。
2、曾经接受过任何选择性雌激素受体降解剂(Selective Estrogen Receptor Downregultors,SERDs)治疗;但首次用药前使用氟维司群>6周和首次用药前使用SERCA或CERAN>3周,这两种情况除外。
3、任何中枢神经系统转移肿瘤。
4、既往抗肿瘤治疗不符合方案规定。
5、在首次使用试验药物前5个药物半衰期内接受过或正在接受其它未上市的临床试验药物或治疗,或2周内接受过或正在进行临床器械研究。
6、在首次使用试验药物前4周内接受过主要脏器外科手术(不包括穿刺活检)或出现过显著外伤,或需要在试验期间接受择期手术。
7、在首次使用试验药物前4周内有严重的无法愈合的伤口/溃疡/骨折。
8、既往抗肿瘤治疗的不良反应尚未恢复到CTCAE v5.0严重程度评价≤1级(经研究者判断无安全风险的毒性除外,如脱发、2级外周神经毒性等)。
9、首次使用试验药物前4周内使用过CYP3A强抑制剂和强诱导剂详见附录5)或食用过西柚或西柚汁者。
10、无法口服药物,或存在经研究者判断严重影响胃肠道吸收的状况,如吞咽困难、治疗难以控制的恶心和呕吐、肠梗阻、胃出口梗阻等。
11、首次使用试验药物前1周内存在活动性感染,且目前需要系统性抗感染治疗者。
12、已知有以下感染史:HIV感染未经过有效抗逆转录病毒治疗或未达到可接受的免疫功能、HBsAg阳性的HBV感染或在给药前需进行预防治疗或抑制性抗病毒治疗、未完成治愈性抗病毒治疗的HCV感染或体内有不可接受的病毒载量,未完成治愈性临床治疗的梅毒感染者,或上述阳性感染经研究者评估不适合入组者。
13、活动性心脏病或心功能不全病史不符合方案规定。
14、临床无法控制的第三间隙积液,经研究者判断不适合入组。
15、已知有药物滥用史。
16、精神疾病障碍由研究者判断导致依从性差者。
17、无法耐受静脉采血者。
18、在过去5年内已知患有其他恶性肿瘤,正发生进展或需要积极治疗(注:除外接受过潜在根治性治疗的皮肤基底细胞癌、皮肤鳞状细胞癌、宫颈原位癌的受试者)。
