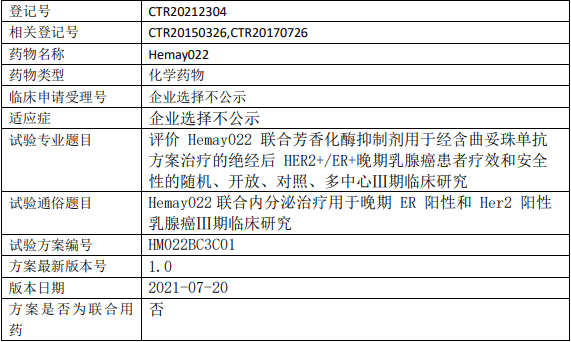
和美药业/和美生物Hemay022临床试验,评价Hemay022片联合芳香化酶抑制剂用于经含曲妥珠单抗方案治疗的绝经后HER2+/ER+晚期乳腺癌疗效和安全性的Ⅲ期临床试验
试验目的
主要目的
基于IRC评估的无进展生存期PFS,评估Hemay022联合AI治疗ER阳性和HER2阳性晚期乳腺癌患者的有效性。
关键次要目的
基于受试者的OS评估Hemay022联合AI治疗ER阳性和HER2阳性晚期乳腺癌患者的有效性。
其他次要目的
基于研究者评估的PFS、ORR、DCR、DOR等指标进一步评估Hemay022联合AI治疗ER阳性和HER2阳性晚期乳腺癌患者的有效性。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性:别女
健康受试者:无
出入排标准
入选标准
1、年龄≥18周岁;
2、必须在试验前对本研究知情同意,并自愿签署书面的知情同意书;
3、病理学(组织学或细胞学)确诊为乳腺癌患者;
4、ER阳性合并HER2阳性(免疫组化IHC检测3+和/或原位杂交ISH检测阳性);可接受既往检测结果;
5、既往接受过含曲妥珠单抗(或曲妥珠单抗生物类似物)方案治疗失败的晚期/转移性乳腺癌;或(新)辅助治疗接受含曲妥珠单抗(或曲妥珠单抗生物类似物)治疗期间或治疗结束后12个月内疾病复发或进展;复发一线经过系统性治疗的患者(既往接受过曲妥珠单抗或曲妥珠单抗生物类似物);或不适合接受曲妥珠单抗治疗的患者;既往抗HER2-ADC类药物治疗失败的也可纳入;
6、至少有一个可以经过CT/MRI评估的病灶(可测量和/或非可测量病灶),符合RECISTV1.1中的可重复评估要求;
7、ECOGPS评分0-1;
8、预计生存时间3个月以上;
9、绝经后女性患者;
10、足够的骨髓、肝、肾及凝血功能;
11、所有以前的治疗相关毒性,在随机分组时必须为CTCAE(5.0版)≤2级,但除外脱发、色素沉着,放疗引起的远期毒性(经研究者判断无法恢复);
12、育龄期女性(包括伴侣)从签署知情同意书开始至末次用药后3个月内无妊娠计划且自愿采取有效避孕措施。
排除标准
1、伴有内脏危象的患者(内脏危象定义为:由症状、体征、实验室检查及疾病快速进展确认的数个脏器功能异常。内脏危象并非单纯指存在内脏转移,而指危重的内脏情况需快速、有效治疗而控制疾病进展,尤其指进展后就失去化疗机会的情况);
2、脊髓压迫或脑、脑膜转移;
3、曾经接受过小分子HER2酪氨酸激酶抑制剂(HER2-TKI)治疗(用药疗程≤2周者除外);
4、入组前4周之内曾经接受过放射治疗;
5、曾经接受过针对晚期乳腺癌>1线的化疗(使用过化疗药物的受试者在入组本研究前必须已经停用化疗药≥4周);
6、吞咽困难或无法口服药物、需要静脉营养、吸收障碍综合征或其它任何对胃肠道吸收产生影响的状况;
7、在入组前2周内或研究期间需合并使用可能影响本品代谢的药物,如CYP3A4强诱导剂或强抑制剂;
8、已知对Hemay022、拉帕替尼、AI(来曲唑、依西美坦)、卡培他滨或同类药物及其辅料有过敏史的患者;
9、以MUGA扫描或超声心动图测得的左室射血分数(LVEF)<50%的患者;
10、抗HIV检测阳性;乙肝表面抗原阳性且HBV-DNA>正常值上限;活动性丙型肝炎病毒(HCV)感染;
11、合并有活动性感染需要静脉抗感染治疗的患者;
12、需要治疗的心律失常(包括房颤、室上性心动过速、室性心动过速或室颤),或有症状需药物治疗的冠心病患者;半年内发生心肌梗塞者;充血性心力衰竭者;
13、经复查确认的QTc间期发生延长(≥500ms)(经Bazette或Fredericia校正);
14、有需要治疗的间质性肺病病史、放射性肺炎病史或临床活动性间质性肺病者;
15、在入组前4周内接受过其它临床试验的药物治疗;
16、入组时距重大手术或创伤后<4周;
17、研究期间必须同时采用其他抗肿瘤治疗:如化疗、靶向治疗、免疫治疗方案、放疗(局部对症放疗除外)等;
18、既往5年内患有其他恶性肿瘤,不包括已治愈的宫颈原位癌、皮肤基底细胞癌或皮肤鳞状细胞癌;
19、研究者认为受试者存在任何不适合参加本临床研究的情况。
