挚盟医药卡农克韦临床试验,评估卡农克韦(ZM-H1505R片)联合恩替卡韦在恩替卡韦经治的慢性乙肝有效性和安全性的II期临床试验
试验目的
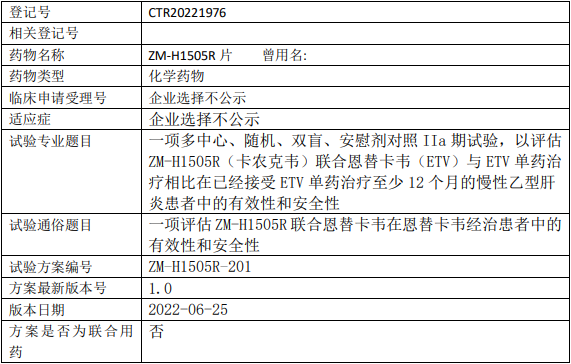
评估ZM-H1505R(卡农克韦)联合恩替卡韦(ETV)与ETV单药治疗相比在已经接受ETV单药治疗至少12个月的慢性乙型肝炎患者中的有效性和安全性。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至65岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、能够理解并签署书面知情同意书(该知情同意书需在进行任何试验评估之前取得);
2、年龄在18-65周岁(含)的成年男性和女性;
3、筛选时已持续使用ETV(0.5mg,QD)单药治疗至少12个月;
4、育龄期女性在筛选期和基线血清妊娠检测均为阴性;
5、育龄期女性或有育龄期女性伴侣的男性,需同意自筛选至最后一次研究药物给药后28天内自愿采取方案规定的避孕方法(参见附录1)。
6、筛选时能提供既往HBV感染的证据(HBsAg和/或HBVDNA阳性)或者筛选时HBsAg阳性;
7、筛选时连续2次间隔至少30天血清HBVDNA<2000IU/mL但≥50IU/mL(血清样本送本试验指定中心实验室检测)。
排除标准
1、筛选时发现进展性肝纤维化或肝硬化,或按照以下方式定义为进展性肝纤维化或肝硬化:在筛选期前1年内通过肝活检判断Metavir≥3或Ishak纤维化评分≥4;亦或者在没有适当的肝活检的情况下,筛选时3个月内肝硬度检查(FibroScan)结果为≥9kPa;
2、既往有HCC病史;或筛选时血清甲胎蛋白(AFP)≥50ng/mL,或腹部B超、电子计算机断层扫描[CT]或者磁共振成像[MRI]等影像学检查提示有HCC可能;
3、筛选时心电图异常且有临床意义或QTcF间期(使用Fridericia公式校正QT):男性>450ms,女性>470ms;
4、合并感染人类免疫缺陷病毒(HIV)、甲型肝炎病毒(HAV)、丙型肝炎病毒(HCV)、丁型肝炎病毒(HDV)或戊型肝炎病毒(HEV);
5、合并其他恶性肿瘤,已通过手术切除治愈的特定癌肿除外(例如基底细胞皮肤癌);
6、合并有非HBV病因的慢性肝病史,例如酒精性肝病、自身免疫性肝病、遗传性肝病、非酒精性脂肪性肝炎等(单纯性脂肪性肝病除外);
7、筛选前6个月内存在持续饮酒(平均每天饮酒男性>40g酒精,女性>20g酒精);
8、有药物依赖或药物滥用史;
9、妊娠期或哺乳期女性;
10、研究者认为因任何其他未列出的原因,不适合参与研究的。
11、筛选时临床实验室参数满足以下任何条件的情况:
1)血红蛋白<120g/L(男性)或<110g/L(女性);
2)血小板<100×109/L;
3)中性粒细胞计数<1.5×109/L;
4)丙氨酸氨基转移酶(ALT)>3倍正常值上限(×ULN);
5)凝血酶原时间国际标准化比值(INR)>1.3;
6)白蛋白<35g/L;
7)总胆红素>2×ULN,且直接胆红素>1.5×ULN;
8)估算的肾小球滤过率<60mL/min/1.73m2。
12、筛选前3个月内使用过其他试验用药物或未经监管机构批准的药物;
13、合并严重的其他系统疾病或临床表现,经研究者判断不适合参加本研究,包括但不限于:
1)循环系统疾病:例如不稳定性心绞痛、心肌梗塞、充血性心力衰竭,控制不佳或难治性高血压(如用药后,收缩压≥160mmHg和/或舒张压≥100mmHg等);
2)呼吸系统疾病:例如严重的慢性阻塞性肺疾病等;
3)原发性或继发性肾脏疾病(如慢性肾功能失代偿、继发于糖尿病、高血压和血管疾病等的肾脏疾病等);
4)内分泌系统疾病:例如控制不佳的糖尿病或甲状腺疾病等;
5)自身免疫性疾病:例如系统性红斑狼疮、原发性血小板减少性紫癜、类风湿关节炎、炎症性肠病、结节病、自身免疫溶血性贫血、银屑病等;
6)神经精神疾病:如癫痫、精神分裂症、抑郁症等;
14、已知存在对本研究试验药物的活性成分或配方辅料过敏。
