肿瘤基因检测阴性是好是坏
癌症的发生机制非常复杂,随着生物技术在医学领域的快速发展和人们在细胞分子水平对癌症发病机制认识的深入,癌症诊疗已进入了全新的基因组时代。目前,对于癌症患者,基于基因检测结果的精准诊疗已被国内外权威指南推荐。然而,并不是所有的患者拿到的基因检测报告都是阳性的,那么阴性报告=患者没有突变?没有临床用药指导意义?其实并不一定!接下来小编整理了几个不一定的原因,供大家参考!
组织or液体活检,不一定能完全揭开肿瘤真面目
《肿瘤二代测序临床报告解读共识》提到,当临床医生面对1份体细胞变异“全阴报告”(即1份样本未能检出任何肿瘤体细胞突变)时,应首先从送检样本和NGS panel两方面来考虑。对于送检样本,应考虑送检样本是肿瘤组织、外周血循环游离DNA(cfDNA)或其他;结合样本质控信息及患者治疗史,综合判断样本中是否含有足够肿瘤成分,DNA总提取量和/或肿瘤占比是否可能低于NGS的最低检测限(LOD)[1]。

一、组织样本
众所周知,组织标本是肿瘤基因检测的“金标准”,因为在组织标本中的肿瘤细胞含量一般要远高于血液或者胸腹水等其他标本类型,因此对组织标本进行检测和分析得到的结果也更加精准可靠。然而不可避免的是,基于肿瘤组织样本的基因检测结果受肿瘤异质性的影响[2]。
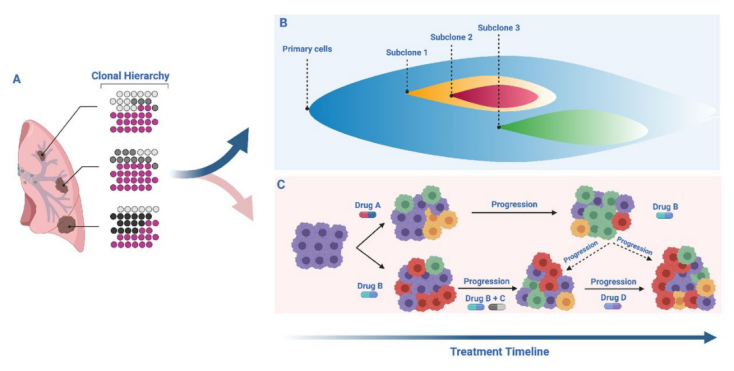
一般送至实验室检测的组织样本仅是一个病灶的一小部分,检测结果并不能代表该病灶的真实情况。此外,原发灶和转移灶之间的肿瘤异质性也是广泛存在的。也有案例报道,一名女性同时发生了3个早期肺部病变,对这3个病灶进行基因检测,检测结果各不相同。这些情况均可导致患者此次检测结果为阴性,但这不等于患者没有突变。因此肿瘤异质性干扰了基于单个肿瘤活检样本检测结果的个体化诊疗策略[3]。CSCO非小细胞肺癌诊疗指南指出原发肿瘤和转移灶均适于靶向驱动基因检测。可采用多个病灶同时检测多个驱动基因突变的技术以克服肿瘤空间异质性,掌握最全面的基因变异信息。

二、血液样本
NCCN指南推荐,晚期患者肿瘤组织不可及时可进行血浆ctDNA(循环肿瘤DNA)检测。ctDNA来源于坏死的肿瘤细胞,携带肿瘤细胞变异信息,ctDNA检测能够避免肿瘤组织间的异质性。

有研究显示,在转移性非小细胞肺癌中,对于指南推荐的生物标志物,ctDNA检测较仅采用组织活检的患者可额外增加48%的检出率,可相对全面地实时反映患者的肿瘤分子特征。但血液中ctDNA片段通常较短,ctDNA含量多少也因人而异,甚至有一些患者的肿瘤细胞极少释放ctDNA,尤其是早期患者或者颅内肿瘤患者,导致检出率有限。《ctDNA高通量测序临床实践专家共识(2022年版)》提到,与肿瘤组织相比,ctDNA检测通常具有很高的特异性,但灵敏度较低,因此检测报告的阳性率也较组织相对较低[4]。但无论是在一线治疗还是在肿瘤进展时,基于血浆检测结果和组织检测结果,都不影响药物决策。
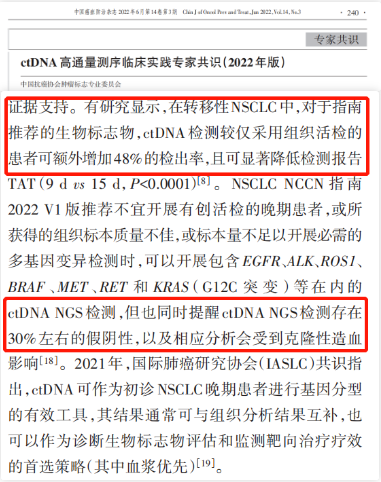
因此,建议患者有组织尽量优先送检组织样本,组织样本不可及时,对于晚期患者可次选液体活检。当然,如果患者条件允许的情况下,可同时送检组织和血液样本,不但能够提高阳性检出率,增大匹配靶向药物的机会,还能够提示肿瘤负荷,预测预后及风险分层。
三、样本质控
对于质控不合格的样本,如果患者重新采样困难,继续检测可能会导致“假阴性”。绘真医学在每一份检测样本上机前,都会进行严格的质量控制,对于质控不合格的样本均会出具质控不合格报告,有效避免了共识中提到的因样本DNA总提取量和/或肿瘤占比低于NGS的LOD而引起的“假阴性”。

检测panel的覆盖范围,可能导致漏检
专家共识提到,选择的NGS panel(尤其是仅包含数个至数十个基因热点区域的小panel)是否与患者的肿瘤类型相匹配,即该肿瘤常见变异是否能被该panel覆盖。比如一份血检全阴报告,采用panel针对泛癌设计、覆盖上百基因的热点区域,对目标癌种常见变异的覆盖度>90%,此时的全阴,很可能仅提示肿瘤全身负荷较低或其他原因(如患者正接受有效的抗肿瘤治疗)导致释放入血的ctDNA含量极低、未达检测平台的LOD。这种“全阴”不能反映肿瘤基因组变异状态,仅能提示“基因突变状态未知”。当然,这种血检全阴报告可以提供突变谱以外的其他信息,在特定场景下提示一定的预测、预后价值。
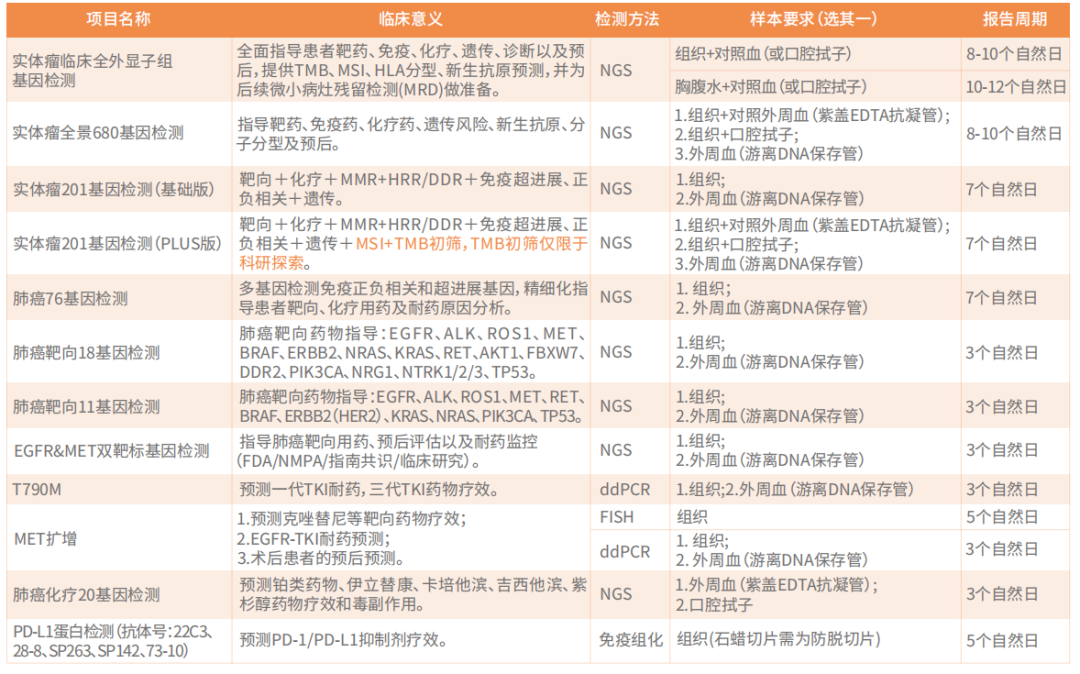
患者在选择检测panel的时候可根据检测目的、样本类型和经济承受能力综合考量。当然选择的panel越大,基因数量越多,覆盖的范围越广,越可能检测到基因突变。以非小细胞肺癌为例,通常建议患者选择680大panel或者201panel,指导靶向、免疫、化疗及预后等,或者次选肺癌76基因检测。尤其是对于耐药患者,耐药机制非常复杂,更要进行NGS大panel检测,最大可能的检出耐药机制。如果患者仅想检测指南推荐的相关基因,可以选择肺癌靶向18基因检测、肺癌靶向11基因检测。具体的检测项目见下表:
检测平台也有Bug
尽管Sanger测序、qPCR、FISH以及NGS平台,均可用于基因变异检测,但限于其自身平台特点,其在检测变异类型、样本类型、检测范围、灵敏度、特异性、检测周期以及检测通量方面,有较大的区别[5],都可能导致“假阴性”结果。客观来讲,没有一种检测平台是完美的,百分之百准确的,因此建议必要时行多平台检测互补和验证。

目前,NGS高通量测序以其通量大、检测下限低、检测变异类型全、适用样本类型多等优势,广泛应用于临床基因检测。绘真医学具备医疗机构执业许可证、检验检测机构资质等,并且绘真医学NGS高通量测序平台连续多年以满分成绩通过美国CAP实体瘤NGS室间质评和国家卫健委临检中心组织的室间质评,检测能力得到国内外权威认证,此外绘真医学一直坚持检测未动,质控先行,最大可能的保证检测结果的真实可靠!
万事俱备,一定全面
在以上条件都满足,即组织样本送检、取材完美、样本保存完好、NGS高深度检测、检测范围覆盖99%可能发生突变的基因、质控良好,也同样可能是阴性结果。原因就在于肿瘤的发生机制非常复杂,涉及到的很多信号通路目前研究并未完全清楚。
以目前研究最为深入的肺腺癌来说,驱动基因也没有完全了解。下图是中国人群非小细胞肺癌(左)和不吸烟的肺腺癌(右)人群的驱动基因突变发生频率。
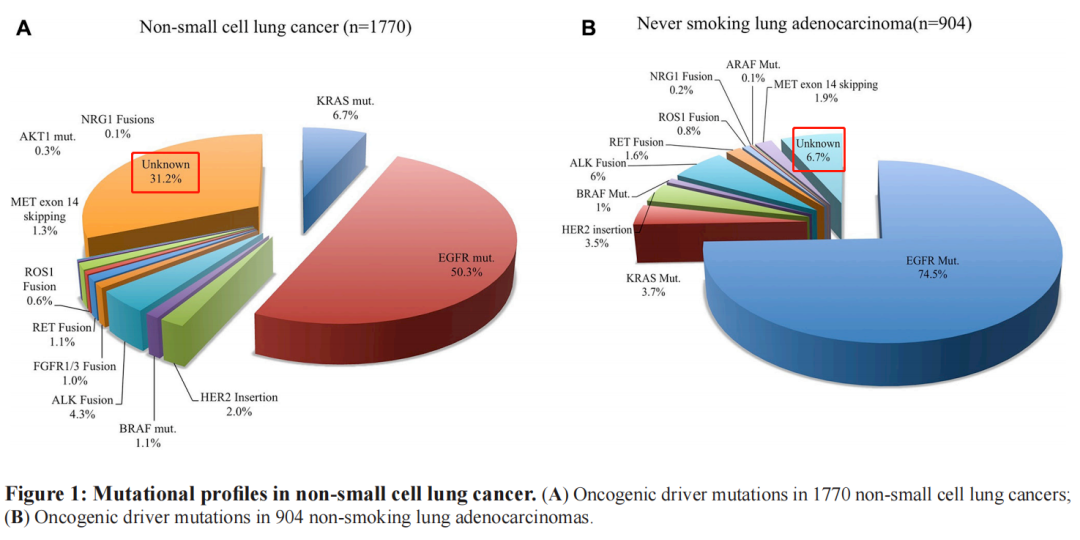
图中Unknown部分分别是31.2%和6.7%,这部分肺腺癌的驱动基因是未知的。如果是其他肿瘤,驱动基因的研究没那么深入,那么检测的阴性率就更高了。
阴性报告,临床意义不可忽视
一、用药指导
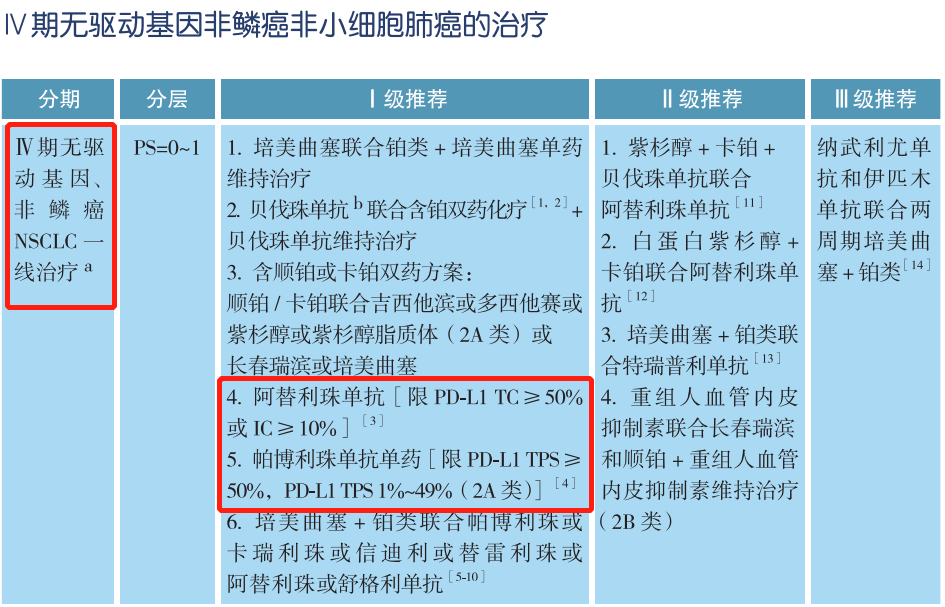
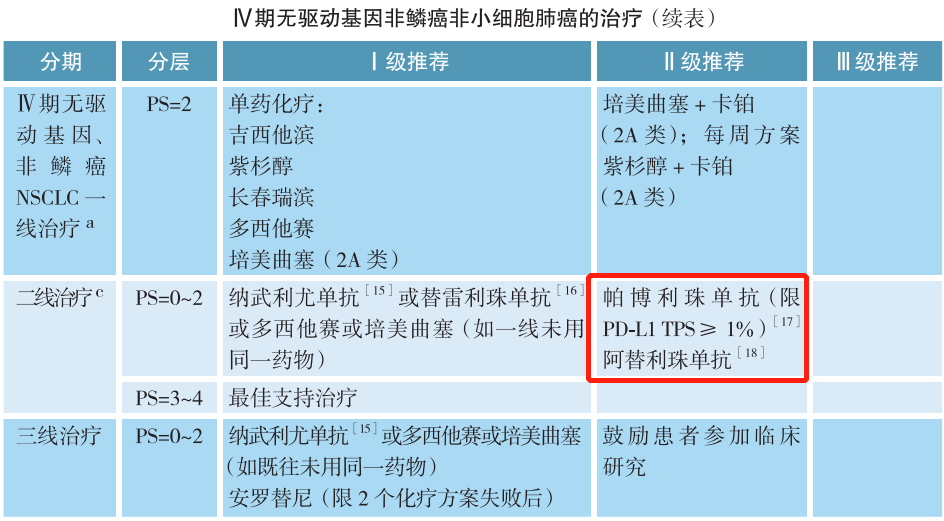
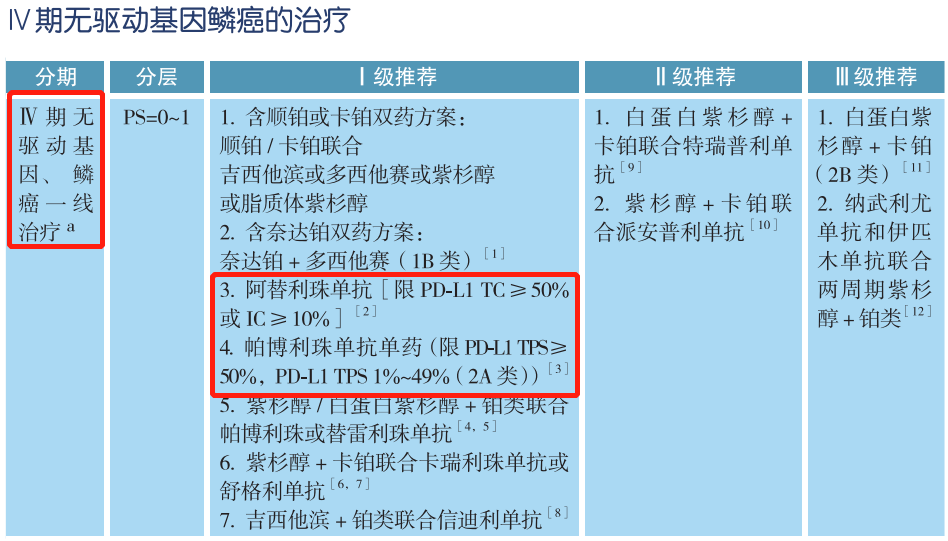
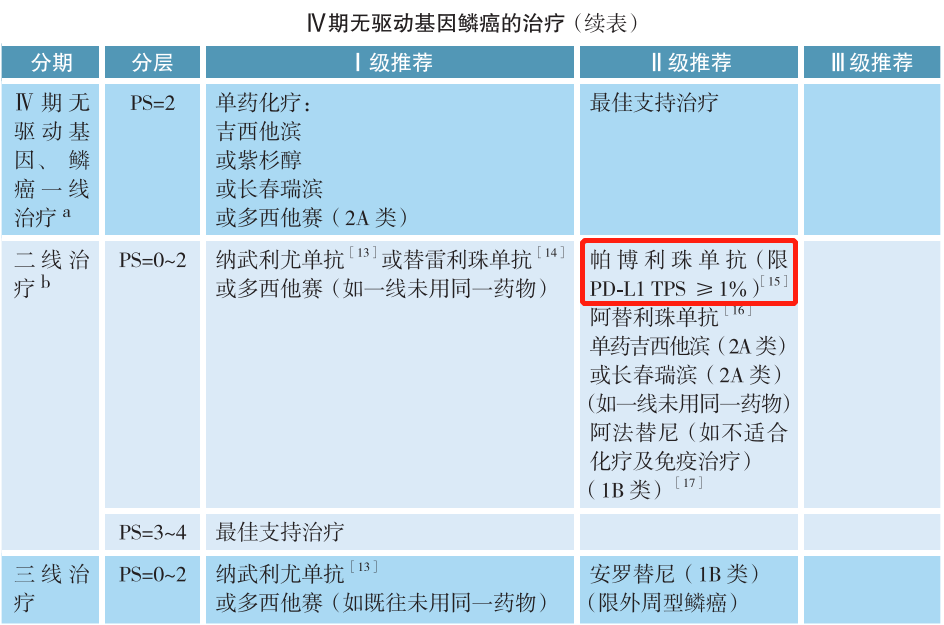
在CSCO非小细胞肺癌诊疗指南中,无论是Ⅳ期非鳞癌非小细胞肺癌还是Ⅳ期鳞癌,驱动基因阴性是免疫检查点抑制剂治疗的前提,也就是我们常说的有靶打靶,无靶免疫。针对Ⅳ期无驱动基因非小细胞肺癌的一线治疗,Ⅰ级推荐中明确指出,阿替利珠单抗限PD-L1 TC≥50%或IC≥10%,帕博利珠单抗单药限PD-L1 TPS≥50%,PD-L1 TPS 1%~49%(2A类);而二线治疗Ⅱ级推荐中,帕博利珠单抗限PD-L1 TPS≥1%。因此,对于驱动基因阴性患者可进行PD-L1蛋白表达检测,预测免疫单药治疗的疗效。当然,PD-L1蛋白表达未知的患者,可考虑使用免疫联合或化疗治疗。
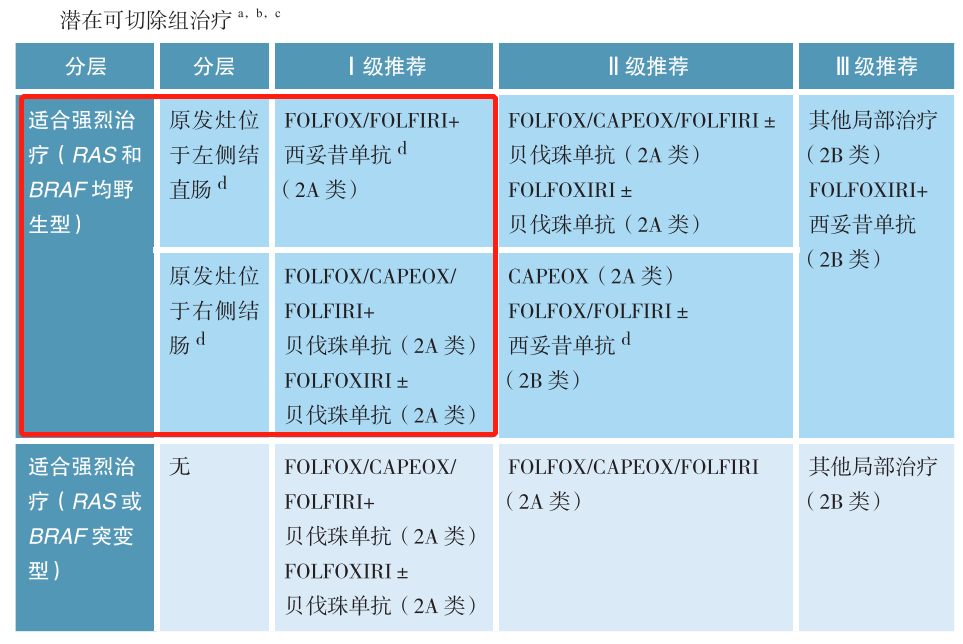
CSCO结直肠癌诊疗指南指出,KRAS、NRAS 和BRAF均野生型患者,如果原发灶位于左侧结直肠,Ⅰ级推荐FOLFOX/FOLFIRI+西妥昔单抗(2A类);如果原发灶位于右侧结直肠,Ⅰ级推荐FOLFOX/CAPEOX/FOLFIRI+贝伐珠单抗 (2A类)、FOLFOXIRI±贝伐珠单抗 (2A类)。
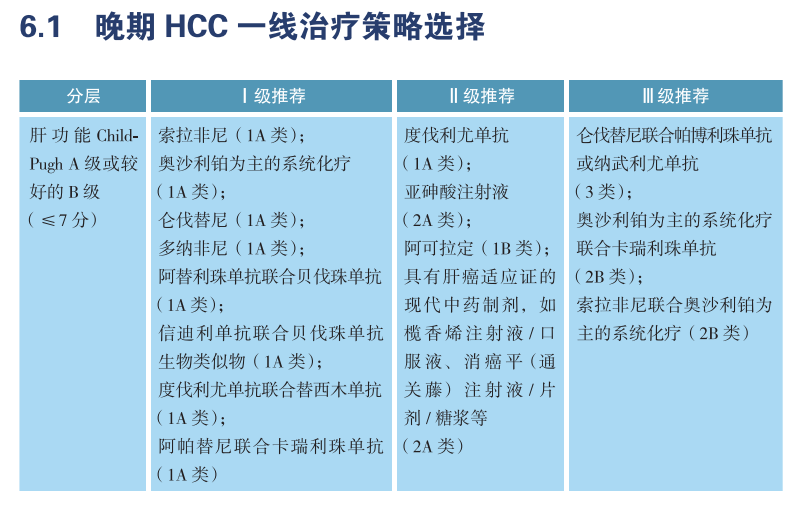
另外,在其他癌种中,检测结果阴性,患者仍然可以考虑接受一些多靶点抑制剂、抗血管生成药物以及免疫检查点抑制剂。例如CSCO指南针对晚期肝细胞癌一线治疗策略选择的推荐,Ⅰ级推荐包括多靶点抑制剂索拉非尼、仑伐替尼和多纳非尼,免疫联合抗血管生成药物,以及双重免疫治疗。
二、预后预测
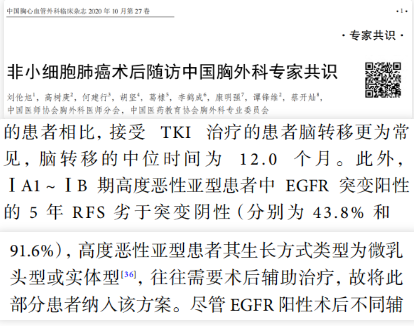
《非小细胞肺癌术后随访中国胸外科专家共识》指出,ⅠA1~ⅠB期高度恶性亚型患者中EGFR突变阳性的5年无复发生存期(RFS)劣于突变阴性(分别为43.8%和91.6%),高度恶性亚型患者其生长方式类型为微乳头型或实体型,往往需要术后辅助治疗[6]。
另外,共识还提到ALK及其它少见突变总体上对NSCLC 患者表现出较差的预后,故在复查随访上应当适当增加随访频率及部位。

综上,可以看出,患者即使拿到一份阴性的基因检测报告,也不要沮丧,因为也有可能有靶药可用,且可能提示预后较好。此外,驱动基因阴性的非小细胞肺癌患者还可进行PD-L1蛋白表达检测,预测免疫单药治疗的疗效,当然,PD-L1蛋白表达未知的患者,可考虑使用免疫联合或化疗治疗。
参考文献:
[1]二代测序临床报告解读肿瘤学专家组. 肿瘤二代测序临床报告解读共识[J]. 循证医学, 2022(002):022.
[2]Antonio Passaro et al. ESMO Open 2020;5:e000919
[3]Intratumor heterogeneity and branched evolution revealed by multiregion sequencing. N Engl J Med. 2012 Mar 8;366(10):883-892. doi: 10.1056/NEJMoa1113205.
[4]中国抗癌协会肿瘤标志专业委员会, 步宏, 邢金良,等. ctDNA高通量测序临床实践专家共识(2022年版)[J]. 中国癌症防治杂志, 2022(003):014.
[5]中华医学会病理学分会, 国家病理质量控制与指导中心, 中华医学会肿瘤学分会肺癌学组,等. 非小细胞肺癌分子病理检测临床实践指南(2021版)[J]. 中华病理学杂志, 2021, 50(4): 323-332.
[6]刘伦旭, 高树庚, 何建行,等. 非小细胞肺癌术后随访中国胸外科专家共识[J]. 中国胸心血管外科临床杂志, 2021, 28(1):7.
内容来源:绘真医讯
