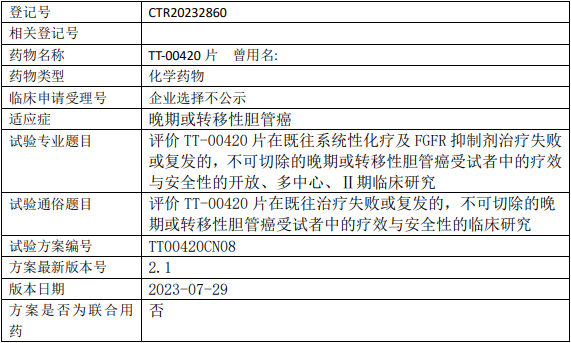
药捷安康TT00420临床试验,评价TT-00420片治疗既往系统性化疗及FGFR抑制剂治疗失败或复发的、不可切除的晚期或转移性胆管癌疗效与安全性的II期临床试验
试验目的
在既往全身系统性化疗及FGFR抑制剂治疗后失败或复发,不可切除的晚期或转移性胆管癌患者中评估TT-00420片的有效性和安全性。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、签署知情同意书时,年龄≥18岁。
2、经组织学或细胞学证实的胆道起源的胆管癌,影像学显示为手术不可切除的晚期或转移性疾病。
3、患者既往接受过1-2线全身系统性化疗(细胞毒性药物)后失败。如果在新辅助或辅助化疗期间或结束后≤6个月有疾病进展或复发,则该化疗也将被视为一线系统性化疗。
4、患者具有医疗文件记录的FGFR2基因变异,且接受过1种FGFR抑制剂治疗后失败的既往病史。FGFR抑制剂定义为已在国内获批胆管癌适应症或已在国内的胆管癌适应症中开展Ⅱ期及以上临床试验的选择性FGFR抑制剂(包括可逆或不可逆性)。
5、根据RECIST v1.1实体肿瘤疗效评价标准,至少具有一个影像学可测量病灶:
1)使用计算机断层扫描(CT)/磁共振成像(MRI),至少有一个非淋巴结的靶病灶最长直径≥10mm,或淋巴结的短轴直径≥15mm;如果仅有一个非淋巴结病灶,则需满足最长径≥15mm;
2)靶病灶的选择应尽量避免既往放射治疗选择的区域,除非有证据表明是放射治疗后的新发病灶或疾病进展。
6、ECOG≤1。
7、患者应具有足够的器官和骨髓功能(首次给药前的14天内,不得接受任何造血生长因子、血液或血小板治疗):
1)中性粒细胞绝对值(ANC)≥1.5×10^9/L;
2)血红蛋白(Hgb)≥9g/dL;
3)血小板(Plt)≥75×10^9/L;
4)AST和ALT≤2.5×正常值上限(ULN),或有肝转移的患者≤5.0×ULN;
5)总胆红素≤1.5×ULN。若有Gilbert综合征或其他肝脏疾病的患者总胆红素<2.5×ULN;
6)肌酐清除率>30mL/min(根据CockcroftGault公式);
7)足够的凝血功能,国际标准化比值(InR)≤1.5。
8、同意在研究期间和治疗结束后至少3个月内采取充足的避孕措施以避免怀孕(包括男性和女性受试者)。
9、能够签署知情同意并能依从试验方案流程。
排除标准
1、合并脑或中枢神经系统(CNS)转移且在治疗开始前28天内影像学或临床证实进展的受试者(例如,新的或扩大的脑转移证据、可归因于脑/中枢神经系统转移的新的神经系统症状);筛选前14天内未经皮质类固醇治疗且保持稳定的脑或中枢神经系统转移可允许入组。
2、同时患有正在进展或需积极治疗的其他恶性肿瘤的受试者;皮肤基底细胞癌、宫颈原位癌或其他非侵入性的或惰性恶性肿瘤,包括既往接受治疗并治愈的肿瘤除外。
3、受试者在启动本试验药物治疗前接受过其他系统治疗或试验药物的治疗,间隔期≤5个半衰期或14天(以较短者为准),或未从既往治疗的不良事件中恢复(≤G1的不良事件或在基线期可耐受的G2级脱发、疲劳/无力和因创伤引起的神经病变除外)。
4、受试者同时进行其他抗肿瘤治疗,包括化疗、免疫治疗、放射治疗;在与申办方讨论后可允许性激素治疗。
5、受试者在启动本试验药物治疗前的4周内接受大面积放射治疗,或2周内接受过局部姑息性放疗,或未从既往治疗的不良事件中恢复(若研究者基于受试者的获益风险比认为尽早使用试验药物更符合受试者的最佳利益,则经申办者同意后,允许洗脱期内开始本试验药物的治疗)。
6、受试者在启动本试验药物治疗前的4周内接受过大的手术,或未从手术的不良事件中恢复(≤G1的不良事件或在基线期可耐受的G2级脱发、疲劳/无力和因创伤引起的神经病变除外)。
7、心功能损害或有明显临床症状的心脏疾病,包括但不限于以下任何一种:
1)纽约心脏协会(NYHA)III或IV级充血性心力衰竭病史;
2)具有尖端扭转(TdP)危险因素,包括低钾血症、先天性长QT间期综合征或QT间期延长综合征的家族史;
3)筛选期心电图(ECG)检查QTcF≥480msec(连续3次检测的平均值);
4)使用试验药物前的3个月内发生不稳定性心绞痛;
5)使用试验药物前的6个月内发生急性心肌梗塞或中风;
6)需要启动治疗或调整治疗方案的心律失常(已安装心脏起搏器或筛选期前4周内心律稳定的患者,可由研究者判断决定是否入组)。
8、受试者筛选期合并使用至少1周稳定剂量的降压药的情况下仍未能有效控制血压(3次间隔5分钟的测量平均值,收缩压≥150mmHg和/或舒张压≥90mmHg)。
9、受试者患有严重的胃肠道疾病或胃肠功能紊乱,可能会导致试验药物的吸收、代谢或排泄,需由研究者判断决定是否入组(包括但不限于胃全切、短肠综合征等)。
10、受试者患有出血障碍或血栓性障碍或需要INR监测的治疗性抗凝治疗,如华法林或任何其他香豆素衍生物抗凝药物。允许使用低分子肝素或新型口服抗凝剂治疗。
11、.受试者在开始试验药物前服用强CYP3A抑制剂和诱导剂(附录E),间隔期≤2周或5个半衰期(以较短者为准);(外用酮康唑除外)。
12、人类免疫缺陷病毒(HIV)检测阳性。
13、患有活动性HBV感染(除乙肝表面抗体阳性或≥ULN之外的其他乙肝病毒血清学检测异常,需进行HBVDNA拷贝数以明确活动性)和/或HCV感染(丙肝病毒抗体异常时需进行HCVRNA拷贝数以明确活动性)。
14、处于妊娠或哺乳期的女性。
15、无法吞咽或耐受口服药物治疗。
16、研究者判定可能混淆试验结果、干扰受试者安全参与和遵守试验流程的任何临床或实验室检查异常或其他原因而不适合参加研究。
