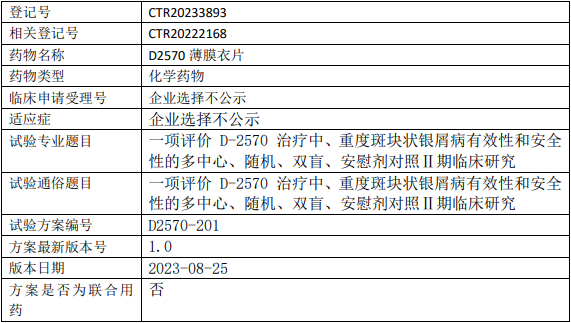
益方生物D2570临床试验,评价D-2570薄膜衣片治疗中、重度斑块状银屑病有效性和安全性的多中心、随机、双盲、安慰剂对照Ⅱ期临床试验
试验目的
主要目的
初步评价不同剂量的D-2570治疗中、重度斑块状银屑病的有效性。
次要目的
1、初步评价不同剂量的D-2570治疗中、重度斑块状银屑病的安全性;
2、评价D-2570在中、重度斑块状银屑病患者中的药物代谢动力学和药效学特征。
试验设计
试验分类:其他其他说明:安全性和有效性,药代动力学/药效动力学
试验分期:II期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至70岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、患者经充分知情同意后自愿参加本研究并签署书面知情同意书,且同意遵守研究方案规定的程序。
2、签署知情同意时18周岁≤年龄≤70周岁,男女不限。
3、研究者评估适合接受系统治疗的斑块状银屑病,且在签署知情同意前病情稳定(稳定的定义:研究者评估为没有形态变化或疾病活动的显著爆发)≥6个月。
4、在筛选期和首次服用试验用药品前,银屑病体表受累面积(BSA)≥10%,医生整体评价(PGA)评分≥3分,银屑病面积与严重程度指数(PASI)评分≥12分。
5、患者血液学指标符合入组标准。
6、患者自筛选开始至末次用药后30天内禁欲或采取有效的避孕措施。
排除标准
1、患有红皮病型银屑病、脓疱型银屑病、点滴型银屑病、反向银屑病、药物导致的银屑病。
2、患有对治疗结果的评估产生影响的其他皮肤病变,如湿疹。
3、带状疱疹/单纯性疱疹病史,或筛选期存在带状疱疹/单纯性疱疹感染。
4、有结核病史,或活动性结核,或潜伏性结核,或临床表现疑似为结核感染。
5、人类免疫缺陷病毒(HIV)抗体阳性,或梅毒抗体阳性,或丙型肝炎病毒(HCV)抗体阳性,或乙型肝炎表面抗原(HBsAg)阳性。乙型肝炎表面抗原(HBsAg)阴性而乙肝核心抗体(HBcAb)阳性的,须进一步进行乙肝病毒(HBV)DNA检测,乙肝病毒脱氧核糖核酸(HBVDNA)检测结果为阳性或病毒载量大于研究中心正常值上限的,也需要排除。
6、随机前的2个月内接种过活疫苗,或有意向在研究期间接种活疫苗。
7、随机前8周内进行过重大手术,或者受试者计划在研究期间进行任何手术,除非研究者评估后判定不会增加受试者风险,或者不会影响受试者接受研究治疗和参加研究的依从性。
8、随机前的3个月内存在需要住院和/或静脉输注治疗的严重细菌、真菌或病毒感染史,或者服用试验用药品前的2周内存在需要抗菌/抗病毒治疗的细菌、真菌或病毒感染。
9、签署知情同意前3个月内发生过心、脑血管事件,或者筛选前3个月内因心、脑血管疾病住院。
10、纽约心脏病协会(NYHA)心功能分级III级及以上的充血性心力衰竭。
11、控制不佳的高血压[静息时检测收缩压≥160mmHg和(或)舒张压≥100mmHg]。
12、患有恶性肿瘤,或签署知情同意前5年内有恶性肿瘤病史(已治愈且无复发征象的皮肤非黑色素瘤、宫颈上皮内瘤变除外)。
13、伴有其他严重的、进展性、或者未能控制的疾病,包括但不限于内分泌系统、血液系统、泌尿系统、肝胆系统、呼吸系统、神经系统、心血管系统、胃肠系统或传染病,且经研究者评估判定受试者参加研究会增加风险。
14、随机前6个月内曾参加,或正在参加任何其他干预性临床试验。
15、存在严重精神疾病或语言障碍,不愿意或不能够充分理解和合作。
16、处于妊娠期或哺乳期的女性。
17、研究者认为不适合参加本研究的其他情况。
