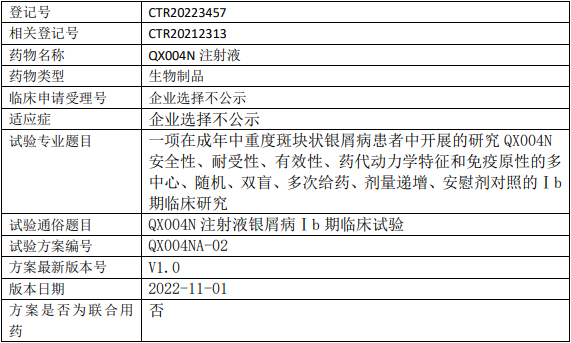
荃信生物QX004N临床试验,QX004N注射液治疗成年中重度斑块状银屑病的Ⅰb期临床试验
试验目的
主要目的
评价QX004N多次皮下注射在成年中重度斑块状银屑病患者中的安全性、耐受性。
次要目的
评价QX004N多次皮下注射在成年中重度斑块状银屑病患者中的有效性、药代动力学(PK)特征及免疫原性特征。为Ⅱ期临床研究推荐合理的给药方案。
探索性目的
评价QX004N多次皮下注射在成年中重度斑块状银屑病患者中的药效学(PD)特征。
试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、自愿作为受试者,并签署知情同意书;
2、签署知情同意书时年龄为18~75岁(含界值),男性或女性;
3、患有慢性斑块状银屑病至少6个月,伴有或不伴有银屑病关节炎;
4、在筛选和基线时,被诊断为中重度斑块状银屑病患者(IGA评分≥3分,银屑病面积和严重程度指数(PASI)≥12分,且累及体表面积(BSA)≥10%);
5、同意在试验期间以及试验结束后6个月内无生育计划且自愿采取有效避孕措施;
6、受试者能够与研究者良好的沟通并能够依照方案要求完成研究。
排除标准
1、患有点滴状银屑病、脓疱型银屑病、红皮病型银屑病或药物诱导性银屑病,或其他影响治疗结果的疾病(皮肤病变或其他系统性自身免疫病等);
2、既往接受过靶点IL-12/IL-23如stelara、IL-23或IL-17药物者;
3、筛选期正在使用违禁药物或在如下时间内使用过违禁药物:
-筛选前2周内接受了可能影响银屑病评价的局部治疗药物[包括不限于皮质类固醇类(糠酸莫米松局部治疗除外)、钙调磷酸酶抑制剂、焦油制剂、维A酸、维生素D3衍生物、卡泊三醇、他扎罗汀、吡美莫司(可以面部使用)、他克莫司(可以面部使用),及复方制剂等];
-筛选前4周内接受了可能影响银屑病评价的系统药物治疗(包括不限于甲氨蝶呤、环孢素、维A酸、补骨脂素、柳氮磺吡啶、硫唑嘌呤、吗替麦考酚酯、羟基脲、阿那白滞素、富马酸衍生物,或JAK抑制剂例如托法替布,巴瑞替尼,或用于治疗银屑病的中药或中成药);
-筛选前3个月内(或在药物5个半衰期内,以时间较长者为准)接受了TNF-α拮抗剂(包括不限于阿达木单抗、英夫利昔单抗、依那西普、戈利木单抗);
-筛选前4周内使用光化学治疗(如补骨脂素联合A波段紫外线暴露疗法[PUVA])或光疗(例如,长波紫外线[UVA]、中波紫外线[UVB]);
4、有证据表明受试者有严重的、进行性的或不可控制的心血管疾病、神经肌肉疾病、血液系统疾病、呼吸系统疾病、消化系统疾病、泌尿系统疾病、内分泌或代谢性疾病、神经或精神疾病等;
5、筛选前6个月曾发生过机会性感染(复发性严重性带状疱疹、巨细胞病毒、支原体、卡氏肺囊虫、组织胞浆菌病、系统性念珠菌病、曲霉菌、非结核分支杆菌等感染)(注:感染消退后,可重新对该患者进行筛选,仅限一次);
6、已知有复发或慢性感染病史,曾患有慢性或反复发作的感染,包括但不限于:
慢性肾脏感染,慢性胸腔感染(如支气管扩张),有症状的尿路感染,开放,引流或皮肤的感染性伤口;
有严重感染病史(例如脓毒血症、肺炎、肾盂肾炎),或在筛选前2个月内因感染住院或接受静脉抗生素治疗;
7、有恶性肿瘤或恶性肿瘤病史(已成功切除并且5年内无复发转移证据的皮肤鳞状细胞癌,基底细胞癌或局部宫颈原位癌除外);
8、患有或曾患有淋巴组织增生疾病,或筛选前5年内存在提示淋巴增生疾病的症状或体征,或脾肿大;
9、已知有活动性结核史者,或者筛选时有活动性或潜伏性结核感染者;
10、筛选前1个月内接种过活疫苗、减毒活疫苗、灭活疫苗、腺病毒载体疫苗;
11、筛选和首次使用研究药物前6个月内接受过试验性生物制剂治疗,或30天内接受过任何试验治疗或在5个半衰期内的研究药物,或正在参加一项临床研究;
12、实验室检查值符合以下任一标准(对于首次检查超出规定值范围的患者可进行二次复查,二次检查结果经研究者判断不影响受试者安全可入组):-血红蛋白<90g/L-白细胞计数(WBC)<3.0×109/L-中性粒细胞计数<1.5×109/L-血小板计数<100×109/L-血清丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)>1.5倍正常值上限(ULN)-血清肌酐>1.2倍ULN;
13、筛选时乙肝两对半检测HBsAg阳性(若HBsAg阴性,但同时满足:
抗-HBc阳性、抗-HBs阴性时,需加做HBV-DNA定量检查,检查结果超过正常值范围则排除);
或丙型肝炎抗体(若抗体阳性,需加做HCV-RNA检测,检查结果超过正常值范围则排除)、梅毒螺旋体抗体阳性(梅毒螺旋体血清学试验呈阳性的受试者需进一步进行非梅毒螺旋体血清学试验,若检测结果为阴性,经研究者判断符合条件的患者入选),及HIV抗体检查阳性者;
14、经询问,怀疑或确认为过敏体质者或既往出现过严重药物、食物过敏反应者,和/或对试验药物或者其中成分过敏者;
15、妊娠或哺乳期女性;
16、研究者认为由于各种原因不适合参加本临床试验者。
