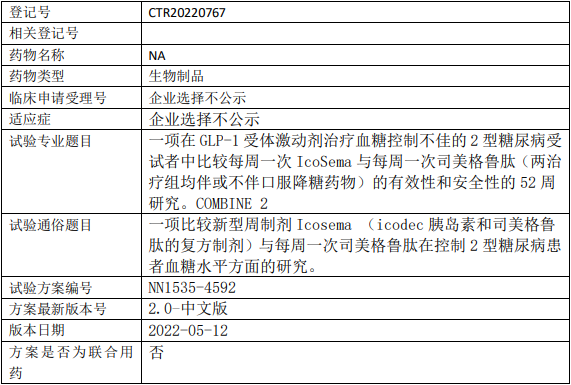
诺和诺德Icosema临床试验,比较新型周制剂Icosema与每周一次司美格鲁肽在控制2型糖尿病血糖水平方面的III期临床试验
试验目的
本研究在2型糖尿病患者中对新药IcoSema(icodec胰岛素和司美格鲁肽的复方制剂)每周一次给药与司美格鲁肽每周一次给药进行比较。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:开放
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1.在进行任何研究相关活动之前获取知情同意。研究相关活动是指作为本研究的一部分进行的任何操作,包括确定试验合格性的活动。
2.男性或女性,签署知情同意时年龄≥18岁。
3.筛选前诊断为2型糖尿病≥180天。
4.筛选时,经中心实验室评估HbA1c7.0-10.0%(53.0-85.8mmol/mol)(含两端值)。
5.未接受过胰岛素治疗。允许以下例外情况:筛选前短期胰岛素治疗不超过14天,和/或既往因妊娠期糖尿病接受胰岛素治疗。
6.筛选前根据当地说明书接受每日或每周GLP-1受体激动剂(剂量高于1.0mg每周一次的司美格鲁肽除外)治疗糖尿病,剂量稳定≥90天。伴或不伴以下任何降糖药物治疗,筛选前剂量稳定≥90天:二甲双胍,磺脲类药物,美格列脲(格列奈类),DPP-4抑制剂,钠-葡萄糖共转运蛋白2抑制剂,α-糖苷酶抑制剂,噻唑烷二酮类药物,仅包括上述产品的市售口服复方制剂。
7.体重指数(BMI)≤40.0kg/m^2。
8.目前未使用实时持续血糖监测或扫描式血糖监测。
9.随机时必须停用磺脲类药物、美格列脲(格列奈类)和DPP-4抑制剂。
排除标准
1.妊娠期、哺乳期或计划妊娠的女性,或有生育能力但未使用高效避孕措施的女性。
2.预期起始或改变已知会影响体重或糖代谢的合并用药连续超过14天(例如使用奥利司他、甲状腺激素或全身性皮质类固醇治疗)。
3.筛选前90天内使用任何入选标准规定以外的有糖尿病或肥胖适应症的药物治疗。
4.筛选前90天内发生过糖尿病酮症酸中毒.
5.筛选前180天内罹患或有(急性或慢性)胰腺炎病史。
6.以下任何一项:筛选前180天内发生心肌梗死、卒中、因不稳定型心绞痛或短暂性脑缺血发作而住院治疗。
7.筛选时慢性心力衰竭,分级为纽约心脏病协会(NYHA)IV级。
8.未经控制和潜在不稳定的糖尿病视网膜病变或黄斑病变。在筛选前90天内或筛选至随机之间,通过眼底检查确证。除非使用明确可进行免散瞳检查的数字眼底照相机,否则必需进行药物散瞳。
研究者信息
主要研究者
姓名:纪立农
学位:医学博士
职称:教授
单位名称:北京大学人民医院
国内参加机构
| 序号 | 机构名称 | (主要)研究者 | 省-市(区) | 地址 |
| 1 | 北京大学人民医院 | 纪立农 | 北京市-西城区 | 北京市西城区西直门南大街11号 |
| 2 | 上海市第五人民医院 | 刘军 | 上海市-闵行区 | 上海市闵行区瑞丽路128号 |
| 3 | 天津医科大学总医院 | 刘铭 | 天津市-和平区 | 天津市和平区鞍山道154号 |
| 4 | 济南市中心医院 | 董晓林 | 山东省-济南市 | 济南市历下区解放路105号 |
| 5 | 南京医科大学第二附属医院 | 鲁一兵 | 江苏省-南京市 | 南京市姜家园121号 |
| 6 | 常州市第二人民医院 | 叶新华 | 江苏省-常州市 | 常州市天宁区兴隆巷29号 |
| 7 | 重庆三峡中心医院 | 罗涌 | 重庆市-万州区 | 重庆市万州区新城路165号 |
| 8 | 惠州市中心人民医院 | 李枢 | 广东省-惠州市 | 惠州市鹅岭北路41号 |
| 9 | 安徽省立医院 | 叶山东 | 安徽省-合肥市 | 合肥市庐阳区庐江路17号 |
| 10 | 复旦大学附属华山医院 | 李益明 | 上海市-静安区 | 上海市静安区乌鲁木齐中路12号 |
| 11 | 天津医科大学朱宪彝纪念医院 | 陈莉明 | 天津市-北辰区 | 天津市北辰区环瑞北路6号 |
