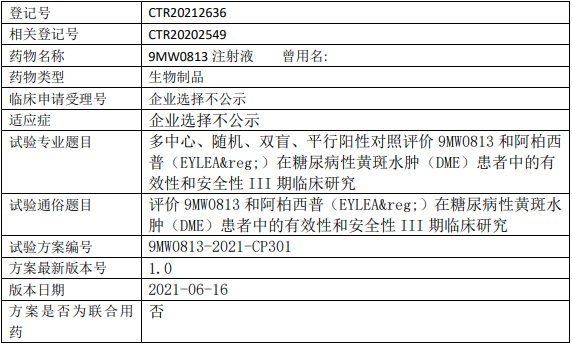
迈威生物9MW0813临床试验,评价9MW0813注射液和阿柏西普(EYLEA®)治疗糖尿病性黄斑水肿(DME)有效性和安全性III期临床试验
试验目的
主要研究目的
比较在DME患者中玻璃体腔内注射9MW0813注射液和阿柏西普眼内注射溶液(EYLEA®)的临床有效性的相似性。
次要研究目的
(1)比较在DME患者中玻璃体腔内注射9MW0813注射液和阿柏西普眼内注射溶液(EYLEA®)的临床安全性的相似性;
(2)比较在DME患者中玻璃体腔内注射9MW0813注射液和阿柏西普眼内注射溶液(EYLEA®)的免疫原性的相似性;
(3)探索在部分DME患者中玻璃体腔内注射9MW0813注射液和阿柏西普眼内注射溶液(EYLEA®)的药代动力学特征。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1.年龄≥18周岁,性别不限;
2.确诊为1型或2型糖尿病,且HbA1c≤10.0%;
3.研究眼的视力损害主要为糖尿病性黄斑水肿导致;
4.筛选及基线时经OCT检查,研究眼的糖尿病性黄斑水肿累及黄斑中心凹,且中央视网膜厚度(CRT)≥300μm(采用SD-OCT)
5.应用糖尿病性视网膜病变早期治疗研究(ETDRS)视力表测得筛选及基线时研究眼的最佳矫正视力(BCVA)在73至24个字母(含临界值)之间(约相当于Snellen视力分数20/40至20/320)
6.根据研究者评估,受试者有意愿且有能力进行所有的访视和评估;
7.受试者自愿参加本研究并签署知情同意书。
排除标准
1.研究眼:
(1)研究眼存在活动性增生性糖尿病性视网膜病变(PDR);
(2)研究眼存在黄斑中心凹的结构性损害,导致黄斑水肿消退后BCVA也可能无法改善(如:视网膜色素上皮细胞萎缩、视网膜下纤维化或瘢痕、明显黄斑缺血或机化硬性渗出物);
(3)研究眼存在除糖尿病性黄斑水肿以外的任意眼部疾病或既往病史,且研究者认为可能影响黄斑评估或中心视力(如:白内障、视网膜血管阻塞、视网膜脱离、黄斑牵引、黄斑视网膜前膜、黄斑裂孔、黄斑出血、累及黄斑的视网膜前纤维增生、各种脉络膜新血管形成);
(4)研究眼存在虹膜红变、玻璃体出血或牵引性视网膜脱离;
(5)研究眼存在控制不佳的青光眼(定义为经抗青光眼药物治疗后眼内压≥25mmHg);
(6)研究眼既往接受过或在研究期间可能接受青光眼滤过术(如:小梁切除术、巩膜咬切术和非穿透性小梁手术);
(7)研究眼既往接受过玻璃体视网膜手术;
(8)研究眼无晶状体(人工晶状体除外);
(9)研究眼存在干扰视力、眼底照相或OCT成像的屈光介质浑浊或瞳孔缩小;
(10)首次给药前90天内研究眼接受过眼内手术(包括白内障手术);
(11)首次给药前30天内研究眼接受过钇铝石榴石囊切开术;
(12)首次给药前90天内研究眼接受过或在研究期间可能接受激光光凝术(全视网膜或黄斑);
(13)首次给药前90天内研究眼接受过眼内、眼周或全身皮质类固醇药物;
(14)首次给药前研究眼接受过Ozurdex®眼内植入剂;
2.任意眼:
(1)首次给药时,任意眼存在任何活动性眼内或眼周感染或活性眼内炎症(例如,感染性结膜炎、角膜炎、巩膜炎、眼内炎、感染性眼睑炎、葡萄膜炎);
(2)任意眼有特发性或免疫介导性葡萄膜炎病史;
(3)独眼患者(定义为对侧眼ETDRS检测的BCVA<19个字母);
3.全身系统:
(1)对试验药物、对照药品或任何辅料成分有过敏史者,或对荧光素或任何研究治疗过程中需使用的成分(如:消毒剂、麻醉剂)有过敏史者;
(2)首次给药前180天内接受过全身性抗血管生成类药物治疗者;
(3)伴有不能控制的高血压(定义为接受抗高血压治疗后,受试者坐位时收缩压≥160mmHg或舒张压≥95mmHg);
(4)首次给药前180天内出现过脑卒中、心肌梗死、短暂性脑缺血发作及其它血栓栓塞性疾病;
(5)首次给药前30天内有外科手术史,或目前有未愈合创口、溃疡、骨折等;
(6)正在接受针对严重全身性感染的治疗;
(7)需血液透析或腹膜透析的肾衰竭,或肾脏移植史;
(8)存在无法控制的临床问题(如严重的精神、神经、心血管、呼吸、泌尿等系统疾病以及恶性肿瘤等);
(9)存在疑似禁忌使用试验药物,或可能影响研究结果解读或研究者认为发生治疗并发症风险高的其它疾病史、其它非糖尿病代谢功能障碍、体检结果、既往或当前临床实验室结果;
4.实验室检查:乙型肝炎筛查阳性(定义为乙肝表面抗原阳性,且HBV-DNA阳性)、丙型肝炎筛查阳性(定义为丙肝病毒抗体阳性,且HCV-RNA阳性)、人类免疫缺陷病毒(HIV)抗体阳性、梅毒螺旋体抗体(Anti-TP)筛查阳性(特异性抗体检查阳性,非特异性抗体检查阴性,且结合临床评估为非活动期感染者除外
5.其他:
(1)妊娠期(本试验中妊娠定义为血/尿妊娠试验阳性)、哺乳期妇女;
(2)研究期间及末次给药后90天内不愿采取有效避孕措施的有生育能力的男性或女性;
(3)首次给药前90天或5个半衰期内(以较长时间为准)使用过任何其他临床试验药物或器械(维生素和矿物质除外);
(4)研究者认为不适合进入本研究的其他因素。
研究者信息
主要研究者
姓名:魏文斌
学位:医学博士
职称:主任医师
单位名称:首都医科大学附属北京同仁医院
各参加医院
| 序号 | 医院名称 | 主要研究者 | 医院地址 |
| 1 | 首都医科大学附属北京同仁医院 | 魏文斌 | 北京市经济技术开发区西环南路2号 |
| 2 | 北京大学第三医院 | 窦宏亮 | 北京市海淀区花园北路49号 |
| 3 | 中国医学科学院北京协和医院 | 戴荣平 | 北京市东城区帅府园一号 |
| 4 | 北京大学人民医院 | 赵明威 | 北京市西城区西直门南大街11号 |
| 5 | 北京医院 | 戴虹 | 北京市东城区东单大华路1号 |
| 6 | 四川大学华西医院 | 张明 | 四川省成都市武侯区国学巷37号 |
| 7 | 浙江省人民医院 | 吴苗琴 | 浙江省杭州市拱墅区上塘路158号 |
| 8 | 南方医科大学珠江医院 | 陆晓和 | 广东省广州市海珠区工业大道253号 |
| 9 | 广西壮族自治区人民医院 | 崔凌 | 广西壮族自治区南宁市青秀区桃源路6号 |
| 10 | 山东省立医院 | 马鲁新 | 山东省济南市槐荫区经五纬七路324号 |
| 11 | 济南市第二人民医院(济南眼科医院) | 韩方菊 | 山东省济南市槐荫区经一路148号 |
| 12 | 石家庄市第一医院 | 任骞 | 石家庄市裕华区建华南大街365号 |
| 13 | 河南省立眼科医院 | 范珂 | 河南省郑州市金水区纬五路7号 |
| 14 | 哈尔滨医科大学附属第一医院 | 张弘 | 黑龙江省哈尔滨市南岗区邮政街23号 |
| 15 | 哈尔滨医科大学附属第二医院 | 原慧萍 | 黑龙江省哈尔滨市南岗区学府路246号 |
| 16 | 吉林大学第一医院 | 郝继龙 | 吉林省长春市朝阳区新民大街71号 |
| 17 | 安徽医科大学第二附属医院 | 陶黎明 | 安徽省合肥市经济技术开发区芙蓉路678号 |
| 18 | 蚌埠医学院第一附属医院 | 王剑锋 | 安徽省蚌埠市龙子湖区长淮路287号 |
| 19 | 海南省眼科医院 | 钟兴武 | 海南省海口市秀英区秀华路19号 |
| 20 | 河北省眼科医院 | 王伟 | 河北省邢台市襄都区泉北东大街399号 |
| 21 | 河北医科大学第二医院 | 刘丹岩 | 河北省石家庄市新华区和平西路215号 |
| 22 | 聊城市人民医院 | 高建鲁 | 山东省聊城市东昌府区东昌西路67号 |
| 23 | 陆军军医大学第一附属医院 | 刘勇 | 重庆市沙坪坝区高滩岩正街30号 |
| 24 | 南昌大学附属眼科医院 | 游志鹏 | 江西省南昌市东湖区八一大道463号 |
| 25 | 南昌市第一医院 | 金昱 | 江西省南昌市东湖区象山北路128号 |
| 26 | 南京市第一医院 | 陈力讯 | 江苏省南京市秦淮区长乐路68号 |
| 27 | 青岛市市立医院 | 周占宇 | 山东省青岛市市北区胶州路1号 |
| 28 | 青岛眼科医院 | 徐海峰 | 山东省青岛市市南区燕儿岛路5号 |
| 29 | 山东中医药大学附属眼科医院 | 温莹 | 山东省济南市市中区英雄山路48号 |
| 30 | 山西省眼科医院 | 郑东萍 | 山西省太原市杏花岭区府东街100号 |
| 31 | 汕头大学·香港中文大学联合汕头国际眼科中心 | 陈浩宇 | 广东省汕头市龙湖区东厦北路广厦新城 |
| 32 | 天津医科大学眼科医院 | 李筱荣 | 天津市西青区复康路251号 |
| 33 | 武汉市中心医院 | 项奕 | 湖北省武汉市江岸区胜利街26号 |
| 34 | 西安交通大学第一附属医院 | 裴澄 | 陕西省西安市雁塔区雁塔西路277号 |
| 35 | 新疆维吾尔族自治区医院 | 丁琳 | 新疆维吾尔自治区乌鲁木齐市天山区天池路91号 |
| 36 | 长治医学院附属和平医院 | 崔云 | 山西省长治市潞州区延安南路110号 |
| 37 | 浙江大学医学院附属第二医院 | 姚克 | 浙江省杭州市上城区解放路88号 |
| 38 | 中山大学中山眼科中心 | 李炳乾 | 广东省广州市越秀区先烈南路54号 |
