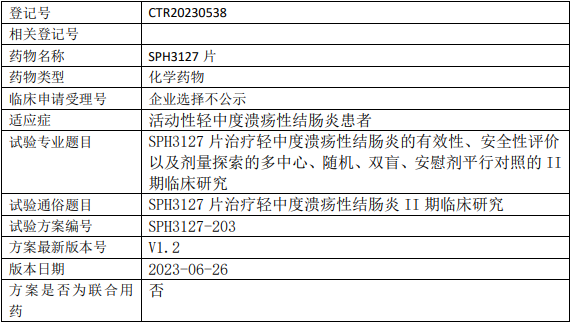
上海医药SPH3127临床试验,SPH3127(苹果酸司妥吉仑片)治疗轻中度溃疡性结肠炎有效性、安全性评价以及剂量探索的II期临床试验
试验目的
以安慰剂为对照,初步评价肾素抑制剂SPH3127片对轻中度溃疡性结肠炎患者的临床有效性,确定推荐剂量。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至 75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄18~75周岁,性别不限;
2、筛选前经评估诊断为溃疡性结肠炎≥3个月;
3、活动性UC,严重程度为轻中度;
4、受试者同意在整个研究期间及末次服药12周内与其配偶采取有效避孕措施;
5、试验前详细了解试验性质、意义、可能的获益、可能带来的不便和潜在风险,理解研究程序且自愿签署知情同意书。
排除标准
1、受试者诊断为克罗恩病或未定型性结肠炎;
2、病变仅局限于距肛门直肠范围内;
3、难辨梭状芽胞杆菌毒素阳性;
4、有结核病史或活动性结核患者;
5、筛选时伴有活动性感染的患者,且经研究者评估后判定会增加受试者风险;
6、有严重的并发症;
7、具有可能影响口服药物吸收的手术治疗的患者,或研究期间需进行手术者,或在筛选前3个月内接受过重大手术,或在研究期间有手术计划者;
8、入组前药物治疗满足以下情况者:使用了抗TNF-α或单抗类生物制剂、免疫抑制剂、粪便菌群移植治疗、抗生素/益生菌等药物;
9、患有心绞痛、心律不齐和充血性心力衰竭,需要药物治疗或筛选期ECG临床显著异常;
10、研究期间需要服用ACEI、ARB类药物及其他肾素抑制剂;
11、肝硬化或ALT/AST>2×ULN;
12、血肌酐>1.5×ULN;
13、凝血功能异常,经研究者判断有临床意义者;
14、筛选前5年内有恶性肿瘤病史;
15、筛选时HIV抗体阳性;HBsAg阳性或HCVAb阳性;
16、既往接受器官移植且需要持续接受免疫抑制剂治疗者;
17、已知对肾素抑制剂过敏者或高敏体质者;
18、妊娠期、哺乳期女性,以及计划试验开始6个月内受孕者;
19、有精神异常病史者;
20、筛选前1年内存在具有临床意义的药物滥用史或酗酒史;
21、筛选前3个月内作为受试者参加过其他药物/器械临床试验;
22、研究者认为任何不宜参加本试验的其他疾病或情况。
