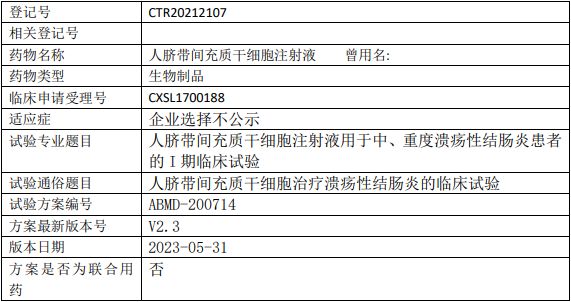
奥克生物人脐带间充质干细胞临床试验,人脐带间充质干细胞注射液治疗中重度溃疡性结肠炎的I期临床试验
试验目的
主要目的
评价人脐带间充质干细胞注射液治疗中、重度溃疡性结肠炎单次、多次给药的安全性、耐受性,探索其最大耐受剂量(MTD)和剂量限制毒性(DLT),为II期临床试验设计提供根据。
次要目的
1、初步评价人脐带间充质干细胞注射液治疗中、重度溃疡性结肠炎的有效性;
2、探索人脐带间充质干细胞注射液的药代动力学(PK)特征和免疫原性;
3、探索人脐带间充质干细胞注射液治疗中、重度溃疡性结肠炎的药效动力学特征。
试验设计
试验分类:其他 其他说明:评价安全性和有效性,探索PK、PD特征和免疫原性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至 65岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄18~65周岁(包含边界值),性别不限;
2、筛选前≥3个月被确诊为溃疡性结肠炎患者;
3、筛选时为活动期溃疡性结肠炎患者;
4、溃疡性结肠炎严重程度:改良Mayo评分≥6分;
5、体重指数(BMI)在16.0~28.0 kg/m2范围内(包含边界值);
6、自愿参加临床试验并签署知情同意书。
排除标准
1、细菌性痢疾、阿米巴痢疾、慢性血吸虫病、肠结核、艰难梭菌感染或巨细胞病毒(CMV)感染、真菌性肠炎等感染性结肠炎,及白塞病、结肠憩室炎、嗜酸粒细胞性肠炎、未定型结肠炎(IC)等非感染性结肠炎者;
2、合并有控制不理想的甲亢者;
3、预计存在中毒性巨结肠、肠穿孔、腹腔脓肿等其他风险,需要手术治疗的重度溃疡性结肠炎患者;
4、既往恶性肿瘤病史、疑似肿瘤;筛选期结肠镜检查显示有异型增生或恶性肿瘤证据者;
5、有结肠镜检查禁忌者;
6、乙型肝炎表面抗原(HbsAg)阳性;丙型肝炎病毒抗体(HCV-Ab)、梅毒螺旋体抗体(TP-Ab)或人类免疫缺陷病毒抗体(HIV-Ab)检查结果呈阳性者;
7、先天性或获得性免疫功能缺陷性疾的患者;
8、合并有严重的心、脑、肝、肺、肾和造血系统等严重原发性疾病,或ALT、AST>正常值上限2倍者,或Scr超过正常值上限者;
9、筛选前3个月内参加过其他临床试验并使用其他试验药物者;
10、妊娠期或哺乳期或计划在试验期间以及试验结束后6个月内妊娠者(包括男性受试者的配偶);
11、过敏体质、既往有严重过敏史者;对包括试验用料及辅料在内的任何成分有过敏反应史者;
12、正在服用治疗精神疾病、抑郁症类药物,且研究者认为其不能充分理解本试验内容,存在方案依从性问题者
13、筛选前使用过干细胞药物治疗的患者;
14、研究者认为有潜在或对本研究评估有干扰的其他危及生命严重并发症(如严重活动性感染尤其肺部感染、溃疡性结肠炎肺部并发症等);
15、既往接受过与溃疡性结肠炎有关的消化系统手术者;筛选前1个月内进行了大手术,或者无法从手术中完全康复,或者预期计划在研究期间或末次给药后1个月内会进行大手术者;
16、曾接受实体器官移植或造血干细胞移植者;
17、筛选前30天内接种任何活疫苗,或受试者计划在研究期间或研究药物末次给药后30天内内接种任何活(减毒)疫苗;
18、基线前7天内接受过环孢素、他克莫司、吗替麦考酚酯或沙利度胺治疗;
19、基线前7天内接受过硫唑嘌呤或6-巯基嘌呤治疗;
20、基线前7天内接受过JAK抑制剂(例如:托法替尼、巴瑞克替尼、芬戈替尼、乌帕替尼)治疗;
21、筛选前30天内接受过粪便菌群移植;
22、筛选前8周内接受过以下任何生物制剂治疗:英夫利西单抗、赛妥珠单抗、阿达木单抗、戈利木单抗、维多珠单抗、那他珠单抗和乌司奴单抗;
23、筛选前60天内或筛选期中,接受过血液净化术的患者;
24、根据研究者的判断,其他不适宜参加本研究的受试患者。
