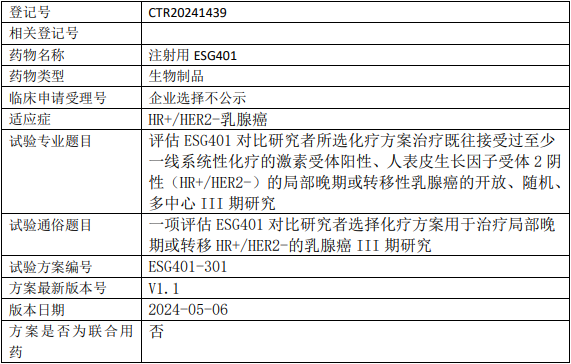
诗健生物/东曜药业ESG401临床试验,评估注射用ESG401对比研究者所选化疗方案治疗既往接受过至少一线系统性化疗的激素受体阳性、人表皮生长因子受体2阴性(HR+/HER2-)的局部晚期或转移性乳腺癌的III期临床试验
试验目的
主要目的
对比ESG401与研究者所选化疗方案由独立中心影像评估的无疾病进展时间(PFS)。
次要目的
对比ESG401与研究者所选化疗方案由研究者评估的无疾病进展(PFS),总生存期(OS),客观缓解率(ORR),临床获益率(CBR),缓解持续时间(DOR)。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、愿意并能够提供本试验的书面知情同意。
2、男性或女性,年龄≥18周岁。
3、受试者须为组织学或细胞学确诊的HR+/HER2-的局部晚期或转移性乳腺癌患者。
4、适合接受TPC中列出的化疗方案之一的患者。
5、受试者应有至少一处可测量病灶。
6、ECOG体能状态为0或1分。
7、预期生存期≥12周。
8、受试者必须有适当的器官功能,并且在试验用药品给药前14天内未接受过输血、促红细胞生成素(EPO)、粒细胞集落刺激因子(CSF)或其他医学支持治疗。
9、具有生育能力的男性和育龄期女性必须同意从签署知情同意书开始直至试验用药品末次给药后180天期间采取有效的避孕措施。
排除标准
1、在试验用药物首次给药前4周内接受过化疗、靶向治疗、免疫治疗、介入治疗或其他系统性抗肿瘤治疗。
2、既往治疗所致不良反应尚未恢复至≤1级。
3、在试验用药品首次给药前4周内接受治疗性放疗或进行了重大手术,或手术后尚未完全恢复。
4、既往接受过含有靶向拓扑异构酶I化疗药物的ADC;或接受过靶向Trop2ADC的治疗。
5、筛选前6个月内新发生的血栓栓塞事件、肠梗阻、胃肠道出血或穿孔。
6、未控制的系统性细菌、病毒或真菌感染。
7、已知存在有症状的或经研究者判断需要治疗但未治疗的脑转移或其他中枢神经系统转移。
8、原发性中枢神经系统恶性肿瘤;或既往3年内被诊断为本次已确认的实体瘤以外的第二原发肿瘤。
9、证据显示严重或未控制的系统性疾病。
10、患有活动性胃肠道疾病,或者既往有严重或慢性腹泻病史的患者。
11、患有具有临床意义的心血管疾病。
12、患有已知的免疫抑制性疾病或人类免疫缺陷病毒感染。
13、筛选时乙型肝炎表面抗原阳性,或丙型肝炎病毒抗体阳性的患者不可入组,除非乙型肝炎病毒(HBV)DNA和HCVRNA检测能明确排除需要乙肝或丙肝抗病毒治疗的活动性感染。
14、妊娠(β-人绒毛膜促性腺激素[β-hCG]测试阳性)和哺乳期妇女。
15、研究者认为患者合并的疾病可能影响对方案的依从性。
16、受试者不愿意或不能遵循方案流程。
17、研究者判定因其他原因不适合参加本研究的患者。
