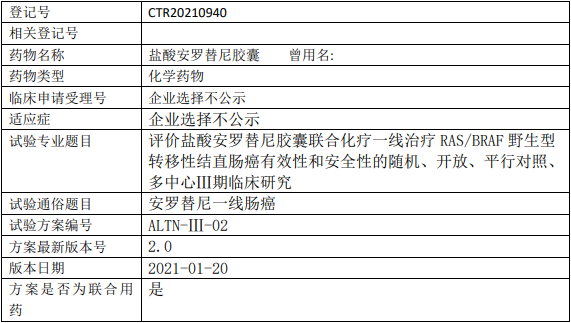
正大天晴安罗替尼临床试验招募,评价盐酸安罗替尼胶囊联合化疗一线治疗RAS/BRAF野生型转移性结直肠癌有效性和安全性的Ⅲ期临床试验
试验目的
主要目的
与贝伐珠单抗联合CapeOx化疗对照,评价盐酸安罗替尼胶囊联合CapeOx化疗在一线RAS/BRAF野生型mCRC受试者中的有效性。
次要目的
与贝伐珠单抗联合CapeOx化疗对照,评价盐酸安罗替尼胶囊联合CapeOx化疗在一线RAS/BRAF野生型mCRC受试者中的安全性。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、受试者自愿加入本研究,签署知情同意书,依从性好;
2、年龄:18-75周岁(签署知情同意书时);ECOGPS评分:0-1分;预计生存期超过3个月;
3、经组织病理学检查确诊的、经MDT讨论确认的不可切除转移性结直肠腺癌(UICC/AJCC结直肠癌TNM分期系统(2017年第8版));
4、基因检测显示RAS、BRAF野生型的患者;
5、根据RECIST1.1标准证实具有至少一个可测量病灶;
6、主要器官功能良好,符合下列标准:
(1)血常规检查标准(筛选前7天内未输血、未使用造血刺激因子类药物纠正):
a)血红蛋白(HGB)≥90g/L;
b)中性粒细胞绝对值(NEUT)≥1.5×109/L;
c)血小板计数(PLT)≥100×109/L;
(2)生化检查需符合以下标准:
a)总胆红素(TBIL)≤1.5倍正常值上限(ULN)(Gilbert综合症受试者,≤3×ULN);
b)丙氨酸基转移酶(ALT)和天门冬氨酸基转移酶(AST)≤2.5ULN。若伴肝转移,则ALT和AST≤5ULN;
c)血清肌酐(CR)≤1.5ULN或肌酐清除率(CCR)≥50ml/min。
(3)凝血功能或甲状腺功能检查需符合以下标准:
a)凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、国际标准化比值(INR)≤1.5×ULN(未接受抗凝治疗);
b)促甲状腺激素(TSH)≤ULN;如果异常应考察T3和T4水平(如中心无T3、T4可用FT3、FT4代替),水平正常则可以入选。
(4)心脏彩超评估:左室射血分数(LVEF)≥50%;
7、育龄女性受试者应同意在研究期间和研究结束后6个月内必须采用避孕措施(如宫内节育器、避孕药或避孕套);在研究入组前的7天内血清妊娠试验阴性,且必须为非哺乳期受试者;男性受试者应同意在研究期间和研究期结束后6个月内必须采用避孕措施。
排除标准
1、存在MSI-H/dMMR的患者;
2、合并以下疾病或病史:
a)3年内出现过或当前同时患有其它恶性肿瘤。以下情况可以入组:治愈的子宫颈原位癌、非黑色素瘤的皮肤癌和表浅的膀胱肿瘤[Ta(非浸润性肿瘤),Tis(原位癌)和T1(肿瘤浸润基膜)];
b)具有影响口服药物的多种因素(比如无法吞咽、慢性腹泻和肠梗阻等);
c)入组前4周内存在或有倾向出现消化道出血或者穿孔等情况;
d)入组前4周内存在活动性炎性肠病的患者;
e)不能控制的需要反复引流的胸腔积液、腹水等;
f)由于任何既往抗肿瘤治疗引起的高于CTCAE1级的未缓解的毒性反应;
g)研究治疗开始前28天内接受了重大外科治疗、切开活检或明显创伤性损伤;
h)影像学(CT或MRI)显示肿瘤侵犯大血管或与血管分界不清;
i)任何出血事件≥CTCAE3级的患者,或不管严重程度如何,存在任何出血迹象或病史经研究者判断不适合入组的患者;
j)存在未愈合创口、溃疡或骨折;
k)6个月内发生过动/静脉血栓事件,如脑血管意外(包括暂时性缺血性发作、脑出血、脑梗塞)、深静脉血栓及肺栓塞等;
l)具有精神类药物滥用史且无法戒除者;
m)存在任何重度和/或未能控制的疾病的受试者;
3、肿瘤相关症状及治疗:
a)研究治疗开始前4周内曾接受过手术(既往的诊断性活检除外)、放疗、化疗或其它抗癌疗法(从末次治疗结束时间开始计算洗脱期);
b)研究治疗开始前2周内接受过NMPA批准药物说明书中明确具有抗肿瘤适应症的中成药(包括复方斑蝥胶囊、康艾注射液、康莱特胶囊/注射剂、艾迪注射液、鸦胆子油注射剂/胶囊、消癌平片/注射剂、华蟾素胶囊等)治疗;
c)既往接受过含有抗血管或抗EGFR靶向药物(包括但不限于贝伐珠单抗、西妥昔单抗、帕尼单抗、阿柏西普、瑞戈非尼等)的术后辅助治疗;
d)既往接受过针对晚期结直肠癌的系统性治疗。
e)伴有症状或症状控制时间少于2个月的中枢神经系统转移者;
4、随机前4周内参加过其他抗肿瘤药物临床试验(从末次治疗结束时间开始计算洗脱期);
5、根据研究者的判断,有严重危害受试者安全或影响完成研究的伴随疾病者,或认为存在其他原因不适合入组的受试者。
