强生特立妥单抗临床试验,比较特立妥单抗注射液(Talquetamab)+泊马度胺、Talquetamab+Teclistamab,与Elotuzumab+泊马度胺+地塞米松或泊马度胺+硼替佐米+地塞米松治疗接受过一种抗CD38抗体和来那度胺治疗的复发性或难治性多发性骨髓瘤的III期临床试验
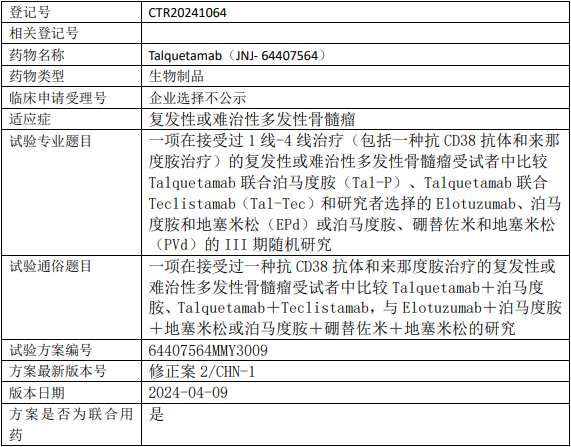
比较特立妥单抗注射液(Talquetamab)联合泊马度胺(Tal-P)、Talquetamab联合Teclistamab(Tal-Tec)和研究者选择的Elotuzumab、泊马度胺和地塞米松(EPd)或泊马度胺、硼替佐米和地塞米松(PVd)治疗接受过1线-4线治疗(包括一种抗CD38抗体和来那度胺治疗)的复发性或难治性多发性骨髓瘤的III期临床试验。
试验目的
试验目的是比较特立妥单抗注射液(Talquetamab)联合泊马度胺或Talquetamab联合Teclistamab与Elotuzumab联合泊马度胺地塞米松或泊马度胺联合硼替佐米地塞米松的疗效。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:开放
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、≥18岁
2、证实患有多发性骨髓瘤,根据以下标准定义:
a)根据IMWG诊断标准(附录9)诊断为多发性骨髓瘤;
b)筛选时根据中心实验室评估确认存在可测量病灶,即符合以下任一定义:血清M蛋白水平≥0.5g/dL(中心实验室);或尿液M蛋白水平≥200mg/24小时(中心实验室);或血清或尿液中无可测量M蛋白的轻链型多发性骨髓瘤:血清IgFLC≥10mg/dL(中心实验室)且血清Igκ/λFLC比值异常(中心实验室)。
3、复发性或难治性疾病。
4、在接受最近一次治疗方案期间或之后,基于研究者根据IMWG标准判断的缓解情况,最后一线治疗后有发生PD或未达到微小缓解的证据。
5、在筛选时和临研究治疗给药开始前,ECOG体能状态评分为0、1或2。
6、受试者必须同意在入组本研究期间和研究治疗末次给药后6个月内不怀孕、哺乳或计划怀孕。
7、受试者必须同意在研究期间和研究治疗末次给药后6个月内不以辅助生殖为目的而捐献配子(卵细胞、卵母细胞、精子)或将其冷冻以供将来使用。因抗癌治疗可能损害生育力,受试者应考虑在开始研究治疗前保存配子。
8、受试者必须同意在入组本研究期间或研究治疗末次给药后6个月内不得有生育计划。
9、既往接受过1线-4线抗骨髓瘤治疗,包括根据给药方案接受过至少连续2个周期的抗CD38mAb治疗(如果抗CD38mAb仅作为维持治疗方案的一部分,则至少接受过6次给药)和连续2个周期的来那度胺治疗。
10、在筛选期以及研究治疗首次给药前72小时内,临床实验室检查值符合标准。
11、HIV阳性的受试者如果符合以下所有条件,则有资格入组:
a)筛选时未检测到病毒载量(即<50拷贝/mL);
b)筛选时CD4+计数>300个细胞/mm3;
c)筛选前6个月内无AIDS定义的机会性感染;
d)正在接受HAART治疗。HAART因耐药/进展导致的任何变更应在筛选前至少3个月发生。筛选前4周内允许因毒性变更HAART。
排除标准
1、对任何研究药物或其辅料存在禁忌症或危及生命的过敏、超敏反应或不耐受。与特定研究药物相关的其他排除标准包括:
a.GPRCD5靶向治疗或泊马度胺;
b.如果存在以下任何一种情况,则受试者无资格在C组接受PVd治疗:不符合硼替佐米再治疗标准(根据IMWG标准,既往硼替佐米治疗后未至少达到PR,或既往硼替佐米治疗期间或治疗停止后6个月内确认发生疾病进展);不耐受,定义为因任何与硼替佐米相关的AE而终止了既往治疗;根据NCI-CTCAE5.0版定义的1级周围神经病变伴疼痛或≥2级周围神经病变;接受过强效CYP3A4诱导剂且随机化前还在其5个半衰期内(见章节6.9.3.3);
c.如果受试者无资格接受EPd治疗(C组):
i.如果受试者既往接受过Elotuzumab治疗;
ii.如果受试者既往未接受过蛋白酶体抑制剂和来那度胺治疗;
d.既往接受过Teclistamab治疗;
e.对任何T细胞重定向治疗耐药的多发性骨髓瘤病史。
2、签署ICF前6个月内发生过卒中、短暂性脑缺血发作或惊厥发作。
3、存在以下心脏疾病:
a.NYHAIII级或IV级充血性心力衰竭(见附录19);
b.随机化前≤6个月内发生过心肌梗死,不稳定型心绞痛,或接受过冠状动脉搭桥术;
c.有临床意义的室性心律失常,或不明原因晕厥病史,非血管迷走神经性或不是由于脱水所致;
d.严重的非缺血性心肌病病史。
4、存在可能干扰研究程序或结果,或者经研究者判定会对参加本研究带来一定风险的合并医疗或精神状况或疾病。
5、接受过以下任一治疗:
a.研究治疗首次给药前6个月内接受过同种异体干细胞移植。接受过同种异体移植的受试者必须在研究治疗开始前6周内停用所有的免疫抑制剂,并且没有移植物抗宿主病的体征;
b.研究治疗给药开始前12周内接受过自体干细胞移植。
6、出现以下任一情况:
a.乙型肝炎感染(即HbsAg或HBV-DNA阳性);
b.活动性丙型肝炎病毒感染,即HCV-RNA检测结果阳性。
7、已知活动性CNS受累或表现出多发性骨髓瘤脑膜受累的临床体征。
8、筛选时患有PC白血病、华氏巨球蛋白血症、POEMS综合征(多发神经病、器官巨大症、内分泌病、M蛋白和皮肤病变)或原发性轻链型淀粉样变性。
9、除多发性骨髓瘤以外的任何活动性恶性肿瘤或者高复发风险的恶性肿瘤。唯一允许的例外情况是在过去24个月内治疗过且已治愈的恶性肿瘤。
