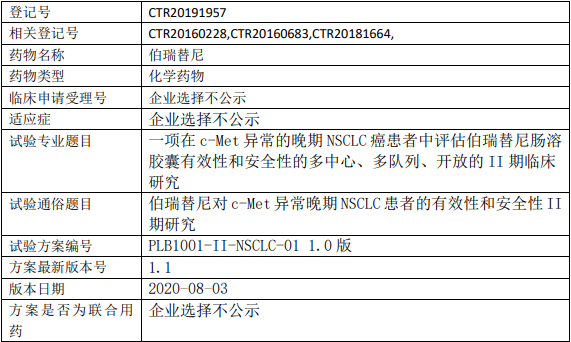
浦润奥生物伯瑞替尼临床试验,伯瑞替尼肠溶胶囊治疗c-Met异常的晚期非小细胞肺癌患者有效性和安全性的II期临床试验
试验目的
1、评估伯瑞替尼在c-Met外显子14突变的晚期NSCLC患者中的有效性和安全性;
2、评估伯瑞替尼在c-Met扩增的晚期NSCLC患者中的有效性和安全性。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、签署参加研究的书面知情同意书;
2、年龄在18岁及以上的男性或女性;
3、经组织学或细胞学证实的晚期非小细胞肺癌患者;
4、EGFRwt、ALK重排阴性、ROS1重排阴性、KRAS突变阴性;
5、证实存在c-Met异常;
6、至少有一处可测量病灶(按RECIST1.1标准);
7、ECOG体力状态分数0-1;
8、预期生存期≥3个月;
9、血液学、血生化和脏器功能正常;
10、研究者判断依从性好,能按方案完成预定访视、治疗和实验室检查。
排除标准
1、不愿意提供肿瘤组织或血液样本进行分子筛选;
2、先前曾经接受过c-Met抑制剂或HGF靶向性治疗;
3、发生有症状的,而且在神经学上不稳定的中枢神经系统CNS转移,或者需要增加类固醇剂量来控制CNS疾病;
4、不稳定或无法控制的疾病或与心功能有关或影响心功能的情形;
5、筛选期静息校正QT间期(QTc)女性>470ms或男性>450ms;
6、任何重要的心律异常如室性心律失常、药物未能控制的室上性、结性心律失常和药物未能控制的其他心脏心律失常;
7、正在接受华法林或任何其它香豆素衍生物抗凝剂治疗的患者,预防中央导管相关血栓形成的低剂量华法林(<2mg)除外;
8、存在既往抗癌治疗毒性未恢复到≤1级(NCI-CTCAE5.0)或基线,脱发除外;
9、可能增加毒性风险的任何合并的医学状况;
10、在开始伯瑞替尼首次给药前2周或≤5倍药物半衰期(以较长者为准)之内接受过抗肿瘤和研究性药物治疗。如果既往治疗为一种单克隆抗体,则必须在伯瑞替尼首次给药之前至少4周停止该治疗。如果既往治疗为一种口服靶向药物,则必须在伯瑞替尼首次给药之前至少5倍药物半衰期停止该治疗。如果既往治疗为中药抗肿瘤治疗则必须在伯瑞替尼首次给药之前至少1周停止该治疗;
11、开始伯瑞替尼治疗之前≤4周行肺野的胸部放疗,或者患者未从放疗相关毒性中恢复。对于所有其他部位(包括胸椎或肋骨放疗),开始伯瑞替尼治疗之前≤2周接受过放疗,或者患者未从放疗相关毒性中恢复。允许患者在开始伯瑞替尼治疗之前≤2周接受骨病灶的姑息性放疗;
12、开始伯瑞替尼治疗之前4周之内接受过重大手术(例如,胸腔内、腹腔内或盆腔内)(2周内接受过脑转移切除术),或者患者未从这些手术的副作用中恢复。胸腔镜手术和纵隔镜检查不算为重大手术,患者可在手术之后≥1周入组;
13、除了NSCLC之外,近3年内还被诊断有另外一种和/或需要治疗的恶性疾病。完全切除的基底细胞和鳞状皮肤癌,以及完全切除的任何类型原位癌除外;
14、患者接受了CYP3A4强效诱导剂和/或强效抑制剂药物治疗,且在开始伯瑞替尼治疗之前至少1周内以及在研究期间不能停止使用;
15、抗HIV(+),或抗HCV和HCV-RNA均为(+),或HBsAg阳性和HBVDNA≥500IU/ml(对于HBVDNA≥500IU/ml患者,在筛选期及研究期间,可以使用抗病毒药物治疗);
16、妊娠或在哺乳;
17、研究期间不能采用充分的避孕措施受试者;
18、目前参加另一项临床试验或在试验药物第一次给药前2周内接受了研究性药物(如果该临床试验药物为单克隆抗体则需要洗脱4周);
19、研究者认为不适合参与研究的其它情形。
