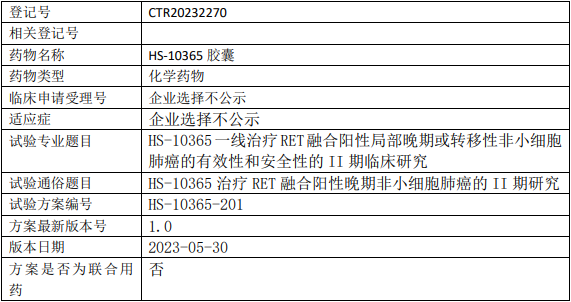
豪森药业HS-10365临床试验,HS-10365胶囊一线治疗RET融合阳性局部晚期或转移性非小细胞肺癌的有效性和安全性的II期临床试验
试验目的
主要目的
评价HS-10365一线治疗RET基因融合阳性局部晚期或转移性NSCLC患者的有效性。
次要目的
1、评价HS-10365一线治疗RET基因融合阳性局部晚期或转移性NSCLC患者的安全性;
2、评价HS-10365在RET基因融合阳性局部晚期或转移性NSCLC患者中的PK特征。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年满18周岁(≥18周岁)的男性或女性。
2、经组织学或细胞学证实的局部晚期或转移性NSCLC患者。
3、RET基因阳性证据。
4、根据RECIST 1.1,受试者至少有1个靶病灶。
5、美国东部肿瘤协作组(ECOG)体力状况评分(PS)为0~1分。
6、最小预期生存大于12周。
7、育龄期女性受试者从签署知情同意书起到末次给药后6个月内愿意采取合适的避孕措施且不应该哺乳;男性受试者从签署知情同意起到末次给药后6个月内愿意使用屏障避孕(即避孕套)。
8、自愿参加本次临床试验,理解研究程序且能够书面签署知情同意书。
排除标准
1、已知存在可能会导致HS-10365治疗耐药的其他经验证的致癌驱动基因。
2、存在有症状的中枢神经系统转移灶、存在脑膜转移或脑干转移;存在脊髓压迫。
3、存在既往抗肿瘤治疗遗留的按不良事件常用术语标准(CTCAE 5.0版)≥2级的毒性。
4、其他原发性恶性肿瘤病史。
5、骨髓储备或肝肾器官功能不足。
6、研究治疗首次给药前4周内,受试者曾接受过大手术。。
7、有严重、未控制或活动性心脑血管疾病。
8、存在控制不佳的胸腔积液、腹腔积液或心包积液。
9、研究治疗首次给药前2周内曾经接受局部放疗;研究治疗首次给药前4周内,接受过超过30%的骨髓照射或接受过大面积放疗。
10、首次给药前6个月内发生过糖尿病酮症酸中毒或高血糖高渗状态;筛选期糖化血红蛋白检测值≥7.5%。
11、严重或控制不佳的高血压。
12、首次给药前1个月内出现过具有显著临床意义的出血症状或具有明显的出血倾向。
13、首次给药前3个月内发生过严重动静脉血栓事件。
14、首次给药前4周内发生过严重感染。
15、需要长期使用类固醇药物治疗。
16、已获知存在活动性传染病。
17、存在临床上严重的胃肠功能异常。
18、肝性脑病、肝肾综合征或≥Child-Pugh B级肝硬化。
19、其他可能会干扰药物相关肺毒性的检测或处理的、严重影响呼吸功能的中重度肺部疾病。
20、既往有严重的神经或精神障碍史。
21、妊娠期、哺乳期或计划在研究期间妊娠的女性受试者。
22、既往有严重过敏史者。
23、经研究者判断可能对研究的程序和要求依从性不佳的受试者。
24、经研究者判断存在任何危及受试者安全或干扰研究评估状况的受试者。
