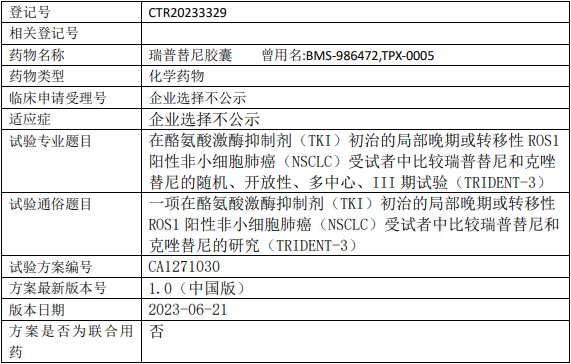
再鼎医药瑞普替尼临床试验,比较瑞普替尼(Repotrectinib、瑞波替尼、洛普替尼、TPX-0005)胶囊和克唑替尼治疗在酪氨酸激酶抑制剂(TKI)初治的局部晚期或转移性ROS1阳性非小细胞肺癌的III期临床试验
试验目的
主要目的
比较瑞普替尼和克唑替尼在TKI初治局部晚期或转移性ROS1阳性NSCLC的所有随机化受试者中经BICR评估的PFS。
次要目的
1、比较瑞普替尼和克唑替尼在TKI初治局部晚期或转移性ROS1阳性NSCLC的所有随机化受试者中的OS;
2、评估瑞普替尼和克唑替尼在TKI初治局部晚期或转移性ROS1阳性NSCLC的所有随机化受试者中的肿瘤应答;
3、评估瑞普替尼和克唑替尼在TKI初治局部晚期或转移性ROS1阳性NSCLC的所有随机化受试者中的研究者;
4、评估的PFS评估瑞普替尼和克唑替尼在TKI初治局部晚期或转移性ROS1阳性NSCLC的所有随机化受试者中的至颅内进展时间;
5、评估瑞普替尼和克唑替尼在TKI初治局部晚期或转移性ROS1阳性NSCLC的所有治疗受试者中的安全性;
6、在TKI初治局部晚期或转移性ROS1阳性NSCLC的所有随机化受试者中评估瑞普替尼和克唑替尼的疾病相关症状。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:开放
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、受试者经组织学或细胞学确诊为局部晚期或转移性NSCLC(IIIB期、IIIC期、IVA期或IVB期,根据第8版美国癌症联合委员会[AJCC]分类。
2、根据当地检测确认,受试者携带ROS1基因重排/融合。无当地ROS1基因重排/融合检测结果的受试者不符合入组要求。(如果根据申办者要求标准当地检测不可接受,则必须进行中心检测)。
3、受试者既往未接受过在ROS1阳性NSCLC中显示活性的TKI治疗(例如,克唑替尼、塞瑞替尼、洛拉替尼、布格替尼、恩曲替尼、恩沙替尼、NVL-520、taletrectinib、foretinib、cabozantinib、Irupliralkib、Unecritinib、XZP-3621、ZG0418、SIM1803-1A和TGRX-326)。
4、针对NSCLC,既往最多允许使用1个前线系统性治疗(含化疗、含免疫治疗、化疗+免疫治疗的联合方案、非ROS1 TKI方案或同步放化疗方案[在确定性胸部放疗期间给药时])。
5、研究者根据RECIST v1.1评估存在至少1处可测量的病灶。
6、ECOG体能状态评分≤2。
排除标准
1、症状性脑转移或症状性软脑膜受累。
2、过去2年内有需要治疗的既往癌症史,研究中的NSCLC、皮肤鳞状细胞癌或基底细胞癌或任何已完全切除的原位癌除外。
3、已知携带其他肿瘤驱动基因突变或重排(如EGFR或ALK)。
4、通过12导联ECG获得的静息校正QT间期>470 ms;心电图的节律、传导或形态出现任何具有临床意义的异常;任何可增加QTc间期延长风险或心律失常事件风险的因素,如血钾过少、血镁过少、先天性长QT综合征、长QT综合征家族史或已知延长QT间期的任何合并用药。
5、具有临床意义的心血管疾病。
6、需要持续全身治疗的已知活动性感染。
7、≥2级周围神经病、异常感觉、头晕、味觉倒错、肌无力或共济失调。
8、既往/合并治疗无法方案要求的限制和禁止治疗;或已知对研究干预成分不耐受的受试者;入组或使用了申办者认为可能干扰研究治疗的任何试验药物或器械;在随机化/治疗前14天内使用辅助药物(例如,产品描述有抗癌适应症的草药补充剂或中药或中成药)或在随机化前既往治疗的所有相关的副作用未消退至≤1级。
9、对研究干预成分或化合物过敏;任何重大药物过敏史。
