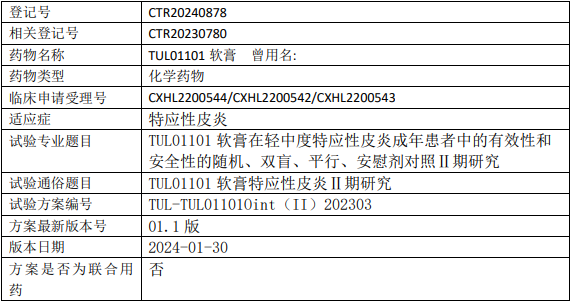
联邦制药TUL01101临床试验,TUL01101软膏治疗轻中度特应性皮炎有效性和安全性的II期临床试验
试验目的
主要目的
评估不同浓度和不同给药频率的TUL01101软膏在轻中度特应性皮炎成年患者中的有效性。
次要目的
评估不同浓度和不同给药频率的TUL01101软膏在轻中度特应性皮炎成年患者中的安全性和药代动力学特征。
试验设计
试验分类:药代动力学/药效动力学试验
试验分期:II期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至 70岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄18~70周岁,性别不限;
2、筛选时符合Hanifin-Rajka标准,诊断为特应性皮炎,且筛选前AD症状≥6个月,由研究者判断为病情稳定者;
3、筛选和基线访视时研究者整体评估量表评分为2分或者3分者;
4、筛选和基线访视时累及的AD皮损区域为体表面积的5-20%;
5、受试者能够与研究者做良好的沟通,在试验前知情同意并自愿签署书面的知情同意。
排除标准
1、已知对本试验用药品或其制剂辅料或其它类似活性药物有过敏史者;
2、特应性皮炎病情不稳定或者始终需要使用强效或超强效局部外用糖皮质激素来控制特应性皮炎的体征和症状者;
3、除特应性皮炎外,筛选时患有其他活动性皮肤病或筛选时皮损区存在大片纹身、胎记、皮肤瘢痕等情况,且经研究者判断会影响特应性皮炎的病情评价者;
4、既往存在或目前患有严重的血液系统疾病或任何可引起溶血或红细胞不稳定的疾病,且经研究者判断可能影响结果评价者;
5、筛选前1年内有活动性结核病史,或筛选前3个月内/筛选期间胸部影像学检查显示活动性结核感染的受试者,或筛选期γ-干扰素释放试验检查结果阳性且经综合评估提示为活动性结核感染者;
6、筛选时有临床重大感染,如需要注射治疗或住院治疗的细菌、病毒、真菌、螺旋体或寄生虫感染者;或既往发生过两次以上带状疱疹或发生过一次播散性带状疱疹史,或其它经研究者认为可能会因参与研究而出现加重的感染史者;
7、既往血栓栓塞病史的患者,或存在其他易导致高凝状态的高风险人群;
8、筛选前5年内有恶性肿瘤史者或淋巴增殖性疾病史;
9、筛选时合并有严重的伴随疾病,可能需要给予系统性激素治疗或其他干预措施,影响研究参与或需要积极频繁的监测者;
10、既往存在或目前有严重的呼吸系统、心脑血管、肝脏、肾脏、消化道、肌肉骨骼、泌尿生殖系统、免疫、内分泌、代谢、精神神经等疾病,且经研究者判断可能影响受试者安全或结果评价者;
11、首次给药前3个月内使用生物制剂治疗AD或其他免疫疾病者;
12、首次给药前4周内接受过JAK抑制剂系统或局部治疗者;
13、首次给药前4周内接受过已知或可能影响特应性皮炎的系统性治疗者;
14、首次给药前4周内接受光疗者;
15、首次给药前4周内使用过全身性治疗AD的中草药者;
16、首次给药前2周内使用可能影响特应性皮炎疗效评价的局部治疗药物,如外用糖皮质激素、外用钙调神经磷酸酶抑制剂、处方保湿剂或含有神经酰胺、透明质酸、尿素或聚丝蛋白等添加剂的保湿剂等;
17、首次给药前1周内在AD皮损部位使用局部用抗菌药者;
18、首次给药前4周内使用过长效的抗凝药物或需要持续使用抗凝药物治疗者;
19、首次给药前3个月内接种活疫苗或减毒活疫苗或1个月内接种灭活疫苗或计划在试验期间接种活疫苗、减毒活疫苗或灭活疫苗;
20、血红蛋白<8.5g/dL;
21、白细胞总数<3.0×109/L;
22、中性粒细胞数<1.2×109/L;
23、血小板计数<0.7倍正常下限,或国际标准化比值>1.5,或活化部分凝血活酶时间>正常上限10s;
24、丙氨酸氨基转移酶或天门冬氨酸氨基转移酶>2.0×ULN,总胆红素>1.5×ULN;
25、血肌酐>1.5×ULN或肌酐清除率<50mL/min;
26、血电解质异常降低且有临床意义者;
27、使用两种及以上降压药物治疗且控制不佳的高血压;
28、研究者认为可能对本研究结果评价产生干扰的任何有临床意义的实验室异常值。
29、筛选时乙型肝炎病毒表面抗原阳性、或乙型肝炎病毒核心抗体阳性且乙型肝炎病毒脱氧核糖核酸超出参考值范围上限、丙型肝炎病毒抗体阳性且丙型肝炎病毒核糖核酸超出参考值范围上限、或人免疫缺陷病毒抗体阳性者;
30、筛选前4周内接受过任何手术或筛选前8周内接受过大手术者;
31、筛选前3个月内参加过其他临床试验者;
32、筛选前6个月内有吸毒史、酒精依赖史、药物滥用史;
33、筛选前12周内失血≥400mL,或接受过血液或血液成份输注者;
34、妊娠期或哺乳期的女性,或在试验期间至末次用药后12周内计划捐献精子/卵子或拒绝采取有效避孕措施的患者;
35、任何研究者认为不适合参与本临床研究的受试者。
