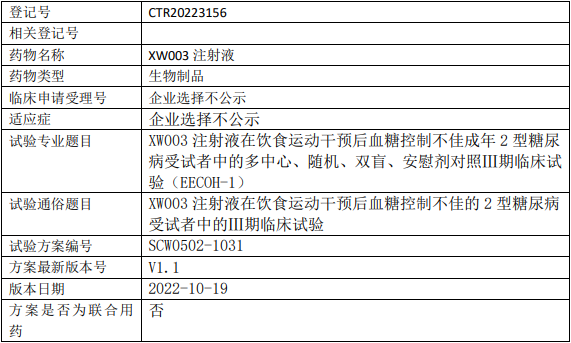
先为达生物XW003临床试验,XW003注射液在饮食运动干预后血糖控制不佳的2型糖尿病的Ⅲ期临床试验
试验目的
在饮食运动干预后血糖控制不佳成年2型糖尿病受试者中评价XW003注射液相对于安慰剂治疗24周的疗效差异。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、男性或女性,知情同意时年龄18-75岁(包括界值);
2、符合体重指数(BMI)≥20.0kg/m2且≤35.0kg/m2;
3、符合世界卫生组织(WHO)1999年颁布的糖尿病诊断标准,确诊T2DM至少3个月,且筛选前8周经过饮食运动控制符合如下条件之一:
a)既往12周内未使用任何降糖药物,或
b)既往12周内仅使用过一种口服降糖药,但筛选前2周内未再使用;
4、筛选时HbA1c≥7.5%且≤11.0%(本地实验室)且随机前HbA1c≥7.0%且≤10.5%(中心实验室);
5、筛选时和随机前空腹血糖(FPG)≤13.9mmol/L(本地实验室);
6、对试验目的充分了解,能够和研究者进行良好沟通,并能理解和遵守本项研究规定的各项要求。
排除标准
1、既往确诊1型糖尿病或其他类型糖尿病;
2、既往甲状腺髓样癌(MTC)或2型多发性内分泌肿瘤综合征(MEN2)个人或家族病史;
3、筛选前3个月内,接受医学或非医学性体重管理,包括未经批准的体重管理药物或产品,或筛选前3个月内体重变化幅度超过5%(以受试者自述为准);
4、既往急慢性胰腺炎病史、有症状的胆囊病史、胰腺损伤史等可能导致胰腺炎高风险因素;
5、既往5年内,诊断恶性肿瘤(治愈的皮肤基底细胞癌或宫颈原位癌除外);
6、既往患有未控制的精神、神经系统疾病;
7、筛选时,乙型肝炎病毒表面抗原[HBsAg]阳性(乙型肝炎病毒[HBV]脱氧核糖核酸[DNA]定量检测结果低于检测参考范围下限者除外)、或丙型肝炎病毒[HCV]抗体阳性、或人类免疫缺陷病毒[HIV]抗体阳性者;
8、已知或疑似对GLP-1类药物或辅料过敏的受试者;
9、筛选时,妊娠或哺乳女性受试者,或受试者(包括男性受试者的女性伴侣)自知情同意前1个月内至末次给药后3个月内有生育计划或捐精捐卵计划,或有生育可能的受试者拒绝使用至少一种有效避孕药物或工具进行避孕;
10、可能因为其他原因而不能完成本研究,或经研究者判断具有其他不宜参加试验原因。
