胃癌基因检测结果报告解读,MSI-H与MMR基因突变的关系如何
在我们每个人的基因组中,存在很多短串联重复序列区域,这些重复DNA区域被称为“微卫星(MS)”,MS在DNA复制过程中容易滑动出现错误,这些错误过度积累后就会诱发肿瘤。与此同时,我们携带的错配修复(MMR)基因(MLH1、MSH2、PMS2、MSH6)就充当了可以识别这些错配错误的安全保障体系,MMR系统将错配的碱基对进行剪切,并合成新链进行修复,一定程度上避免了癌症的发生[1]。总的来说,正常的MMR基因是抵制肿瘤发生的一道屏障,而MMR基因变异则会导致MMR蛋白功能缺失,无法彻底修复复制错误的MS,造成微卫星高度不稳定性(MSI-H)的现象,继而导致肿瘤。这样看来,肿瘤患者的MMR基因突变与MSI-H状态似乎是匹配对等的关系,那么,表现为MSI-H的肿瘤就一定也携带MMR基因变异?实则不然。今天我们从一篇真实的检测案例来剖析其中的奥秘。
病 例
患者信息:女、69岁
病理诊断:胃腺癌
样本类型及采集日期:石蜡切片+对照血;2022-09
检测项目:实体瘤全景680基因检测组织版
样本经过标准的检测流程及生信分析后,患者样本中检出KRAS p.Gly13Asp; ARID1A p.Gly1274*等多个靶向基因变异,但相关靶向治疗方案均处于临床试验状态,证据等级不高。而值得关注的是,在免疫治疗指标上,患者同步检出了胃癌中高证据等级的MSI-H和TMB-H(图1)。

图1.患者免疫治疗指标检测情况
患者检出MSI-H和TMB-H,双重指标加持免疫治疗
根据临床提供信息,该患者为晚期胃腺癌,在靶向治疗方案上,并未检出高证据等级的用药指导方案,且相关靶向药物可及性差。然而,患者同步检出的MSI-H和TMB-H两个免疫治疗有效指标能够提示免疫治疗应该成为患者关注的治疗方案。目前,有多个临床研究证实了MSI-H的胃癌患者接受免疫检查点抑制剂(ICIs)的疗效优于化疗。例如,在KEYNOTE-061研究中,MSI-H的胃癌患者在使用帕博利珠单抗单药和单独化疗后的ORR分别为46.7%和16.7%,而且,免疫治疗的中位无进展生存期也优于化疗,充分表明了MSI-H指标是晚期胃癌患者行免疫治疗的有效标志物,且无论其接受的治疗线如何(图2)[2]。除此之外,在KEYNOTE-062 III期临床研究中,证实了MSI-H和TMB-H均为帕博利珠单抗单药治疗胃癌患者的单独优势指标,对于MSI-H的胃癌患者,帕博利珠单抗和化疗的ORR为57.1%和36.8%,而对于TMB-H的患者来说,两者ORR分别为73.3%和41.2%,中位PFS分别为11.1月和7.0月,中位OS分别为31.6月和13.4月(图2, 图3)[3-4]。
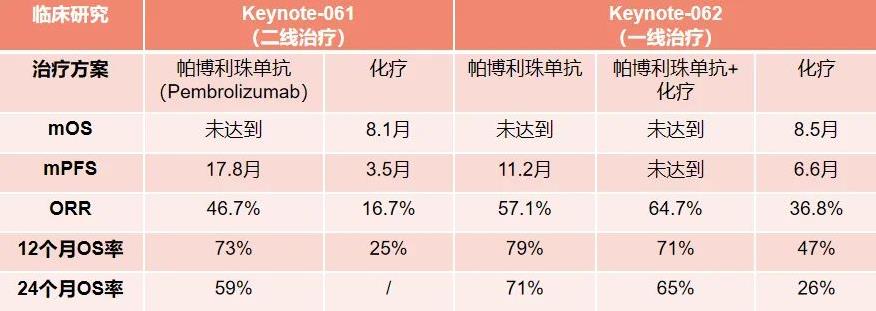
图2. KEYNOTE-061和KEYNOTE-062临床试验MSI-H患者治疗数据
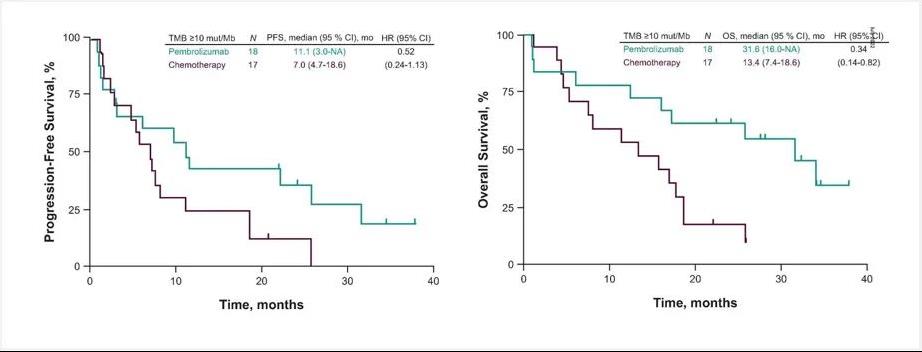
图3. KEYNOTE-062临床试验TMB-H患者治疗数据
目前,MSI和TMB已经被NCCN胃癌指南推荐指导帕博利珠单抗、多塔利单抗等免疫药物治疗(图4);2022年最新版CSCO胃癌诊疗指南推荐所有新诊断的胃癌患者均需检测MSI/MMR以确定分子分型,同时指导患者一线、二线治疗使用帕博利珠单抗等免疫药物,扩大胃癌患者免疫治疗受益人群。可以看出,MSI和TMB检测在胃癌治疗方案制定中的重要指导意义(图5)。而该患者在这种双重免疫疗效证据的加持下,更加坚定了免疫治疗的获益希望!

图4. 胃癌NCCN指南推荐后线治疗检测MSI/MMR和TMB

图5. CSCO指南推荐胃癌患者评估MSI/MMR状态及指导免疫用药
TMB-H和MSI-H高度一致,患者同步检出并非偶然
2017年,权威机构FMI发布了综合10万例肿瘤患者的数据分析表明,在表现为MSI-H的肿瘤样本中,有83%的患者同时也表现为TMB-H,然而反过来看,只有16%的TMB-H样本同时表现为MSI-H(图6)。文章还发现,在胃腺癌,十二指肠腺癌和小肠腺癌等胃肠系统肿瘤中,MSI-H和高TMB几乎总是共同发生的,这也解释了本案例中胃癌患者检出TMB-H和MSI-H并非偶然。而MSI-H指标在黑色素瘤,鳞状细胞癌中和肺癌中比较罕见,TMB-H反而比较常见[6]。上述研究数据也被纳入了国内《肿瘤突变负荷检测及临床应用中国专家共识(2020年版)》,该共识明确指出[5],在TMB和MSI的关系上,MSI-H作为基因组不稳定性的重要标志物,携带该指标亚型的患者通常也伴随TMB-H。而且,TMB与其他肿瘤免疫治疗相关标志物联合应用,或能提高免疫治疗疗效预测的准确性和精确性。也凸显出MSI和TMB检测在肿瘤免疫治疗中的重要地位。
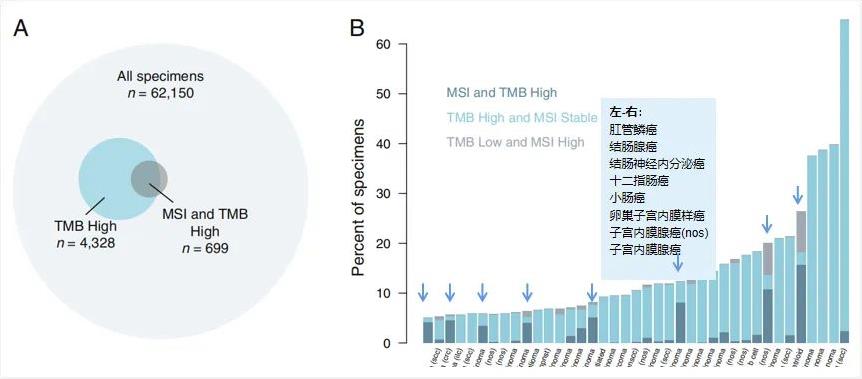
图6. MSI-H和TMB-H一致性数据
MSI-H和MMR突变并非一一对应,MMR蛋白"位居其中"
本案例中,患者在未检出MMR基因突变的情况下,检出MSI-H的结果,这种现象可能令很多朋友不解。事实上,这种现象是客观存在的。下面我们做进一步解释。
1、MMR基因与MSI-H的关系:
通常MMR基因发生突变会导致行使错配修复功能的MMR蛋白发生功能缺陷,无法修复细胞中微卫星(MS)的突变,突变经过积累后才进一步会引发MSI-H。从这个流程看,MMR基因缺失和MSI-H之间还存在一个MMR蛋白的功能缺陷(dMMR)(图7)。因此,dMMR处于衔接MSI-H和MMR基因突变的中间位置,与两者的一致性无疑成为重要的原因。
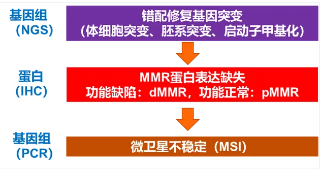
图7. MMR基因、MMR蛋白与MSI-H的关系
2、MMR蛋白与MSI-H的一致性:
有研究表明[7],免疫组化和PCR-毛细管电泳法的微卫星不稳定性检测结果一致性为90.3%(56/62),然而,在dMMR中检出MSS(8.6%, 3/35)以及pMMR中检出MSI-H(11.1%, 3/27)的情况也有发生(图8),该数据也被纳入《子宫内膜癌分子检测中国专家共识(2021年版)》。所以在dMMR和MSI-H之间具有高度的一致性,但实际也并非完全一致。另外针对这种不一致情况,专家共识给出解决策略(图9),可考虑采用第3种方法(NGS或者PCR)进行MSI状态验证。
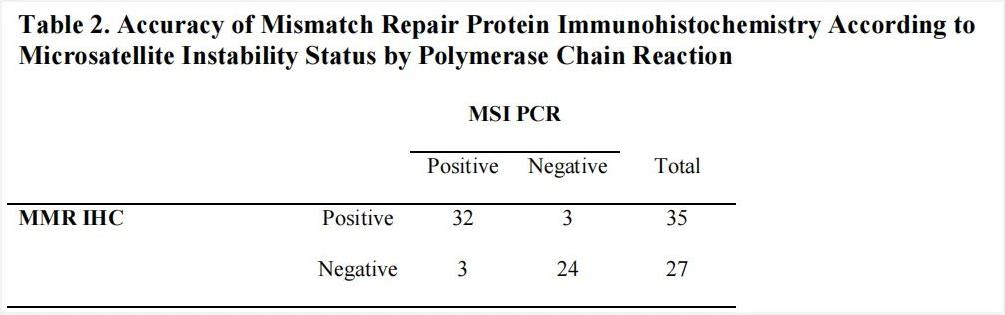
图8. MSI-H结果与MMR蛋白一致性比较

图9. 共识关于MMR蛋白表达和MSI不一致的检测推荐
3、MMR基因突变与MMR蛋白的一致性:
导致MMR蛋白缺失的原因不仅限于MMR基因的胚系突变,另外还有一些MMR基因的甲基化,例如,MLH1基因甲基化。有研究在1057例MSI-H样本中发现,MLH1和PMS2两个基因的IHC蛋白表达和NGS突变表现出高度的不一致,主要体现在IHC蛋白表达缺失而基因未突变[8]。另外,由于MMR基因涉及但不限于MLH1、MSH2、MSH6、PMS2等经典林奇综合征相关基因,还有其他POLE、POLD等基因突变导致MMR蛋白缺陷,同样可能表现为MSI-H[9]。也有小队列研究显示,在12例确认为dMMR/MSI-H的肿瘤患者中,只有66.7%的患者检出了MMR基因突变(图10)[10]。
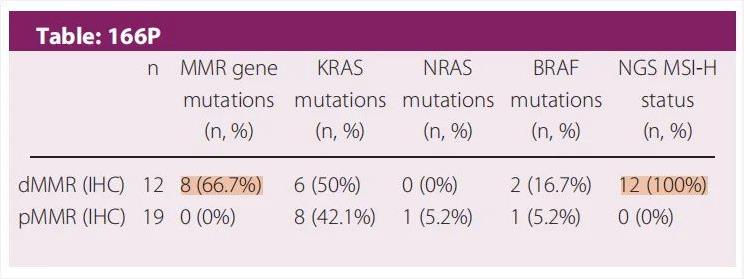
图10. MMR蛋白、MSI-H与MMR基因突变的小队列研究结果
另外,我们都知道林奇综合征确诊的金标准是MMR基因发生功能缺失性突变,而且CSCO诊疗指南明确指出,MSI-H只是林奇综合征的初筛手段,并非确诊指标,MSI-H患者还需进一步检测MMR基因突变才能确诊。所以,从指南的角度来说MMR基因突变并非与MSI-H指标一一对应。
综合来看,肿瘤患者中MMR蛋白表达缺失与肿瘤MSI-H状态以及MMR基因突变都具有较高的一致性,虽然不一致现象较少出现,但也是客观存在,尤其在MMR基因突变和MSI-H之间更为常见。
总而言之,无论是MMR蛋白表达缺失,MSI-H还是TMB-H,三个指标都已经获批于实体瘤的免疫治疗指导,即只要有阳性指标,就预示着免疫治疗可能给患者带来治疗希望。同时,鉴于上述三个指标检测涉及了多平台检测,这往往会给临床带来一定的困难,而且考虑MSI-H和dMMR的高度异质性,目前通常以MSI的检测状态为免疫治疗指标的主要标准。如今,NGS技术能够同步实现MSI、TMB和MMR基因突变的检测!不仅可以为患者提供免疫治疗的机会,还能同步检测MMR基因突变帮助患者确诊是否为林奇综合征。NGS技术着实为患者和临床提供更多的诊疗信息,也深受指南推荐。
参考文献
[1]Li K, Luo H, Huang L, Luo H, Zhu X. Microsatellite instability: a review of what the oncologist should know. Cancer Cell Int. 2020 Jan 13;20:16.
[2] Shitara K, Özgüroğlu M, Bang YJ, Di Bartolomeo M, Mandalà M, ,et,al. KEYNOTE-061 investigators. Pembrolizumab versus paclitaxel for previously treated, advanced gastric or gastro-oesophageal junction cancer (KEYNOTE-061): a randomised, open-label, controlled, phase 3 trial. Lancet. 2018 Jul 14;392(10142):123-133.
[3] Shitara K, Van Cutsem E, Bang YJ, Fuchs C, Wyrwicz L,et,al. Efficacy and Safety of Pembrolizumab or Pembrolizumab Plus Chemotherapy vs Chemotherapy Alone for Patients With First-line, Advanced Gastric Cancer: The KEYNOTE-062 Phase 3 Randomized Clinical Trial. JAMA Oncol. 2020 Oct 1;6(10):1571-1580.
[4]Chao J, Fuchs CS, Shitara K, Tabernero J, Muro K,et,al. Assessment of Pembrolizumab Therapy for the Treatment of Microsatellite Instability-High Gastric or Gastroesophageal Junction Cancer Among Patients in the KEYNOTE-059, KEYNOTE-061, and KEYNOTE-062 Clinical Trials. JAMA Oncol. 2021 Jun 1;7(6):895-902.
[5] 辇伟奇、聂勇战、应建明、张海伟、章必成、申鹏、王宏伟. 肿瘤突变负荷检测及临床应用中国专家共识(2020年版)[J]. 中国癌症防治杂志, 2020, 12(5):10.
[6] CHALMERS Z R,CONNELLY C F,FABRIZIO D,et al.Analysis of 100,000 human cancer genomes reveals the landscape of tumor mutational burden[J].Genome Med,2017,9(1):34.
[7]Saeed OAM, Mann SA, Luchini C, Huang K, Zhang S, Sen JD, Piredda ML, Wang M, Baldrige LA, Sperling RM, Curless KL, Cheng L. Evaluating mismatch repair deficiency for solid tumor immunotherapy eligibility: immunohistochemistry versus microsatellite molecular testing. Hum Pathol. 2021 Sep;115:10-18.
[8]Salem ME, Bodor JN, Puccini A, Xiu J, Goldberg RM, Grothey A, Korn WM, Shields AF, Worrilow WM, Kim ES, Lenz HJ, Marshall JL, Hall MJ. Relationship between MLH1, PMS2, MSH2 and MSH6 gene-specific alterations and tumor mutational burden in 1057 microsatellite instability-high solid tumors. Int J Cancer. 2020 Nov 15;147(10):2948-2956.
[9]Zhu M, Cui H, Zhang L, Zhao K, Jia X, Jin H. Assessment of POLE and POLD1 mutations as prognosis and immunotherapy biomarkers for stomach adenocarcinoma. Transl Cancer Res. 2022 Jan;11(1):193-205.
[10]Wang, S et al. “Association of MMR protein expression and MMR gene mutations in Chinese colorectal cancer patients.” Annals of oncology : official journal of the European Society for Medical Oncology 29 Suppl 8 (2018): viii52 .
内容来源:绘真医讯
