CAR-T细胞疗法上演'碟中谍'!用'诱'欺骗癌细胞,长期高效抗癌,DCR破90%,横扫血癌、肝癌、肠癌等
B细胞急性淋巴细胞白血病(B-ALL)是一种高度侵袭性的血液系统恶性肿瘤,作为儿童群体中发病率最高的癌症类型,约占儿童癌症病例的35%,且发病范围覆盖全年龄段人群。尽管抗癌技术的迭代显著改善了患者预后,但令人痛心的是,超过半数初始治疗有效的患者仍会面临疾病进展的困境。因此,探索创新疗法、提升CAR-T细胞的持久疗效已成为刻不容缓的医学使命。
令人振奋的是,近期西班牙国家癌症研究中心(CNIO)领衔的科研团队在权威期刊《Blood(血液)》发布的一项突破性成果,正以智慧之刃斩断癌症复发的枷锁。该研究不仅精准剖析了B细胞急性淋巴细胞白血病(B-ALL)复发的核心机制,更开创性地提出解决方案:即通过工程化改造T细胞,使其分泌TIM-3-Fc诱饵蛋白——这一"智能铠甲"可精准阻断癌细胞的"免疫逃逸陷阱",重塑CAR-T细胞的抗癌战斗力。
这一发现犹如穿透阴霾的灯塔,不仅为万千B-ALL患者点燃治愈希望,更凭借其跨时代的技术突破,为攻克实体瘤开辟了崭新的路径!

▲截图源自“Blood”
破解肿瘤"免疫逃逸术",利用TIM-3诱饵,开启CAR-T疗法长效抗癌新时代
B细胞急性淋巴细胞白血病(B-ALL)复发的关键机制,或与肿瘤对免疫检查点通路的劫持有关。免疫检查点作为机体防御系统的"安全阀门",本应在清除感染后及时关停免疫攻击;然而,癌细胞却将这一机制异化为逃逸盾牌——即使面对CAR-T这种"活体抗癌武器",肿瘤仍能使其陷入"免疫麻痹",阻断攻击指令。而如今这一治疗难题终于有了突破口!
破解肿瘤复发的关键奥秘
《血液》杂志发布的这项研究,通过分析47例初诊及38例复发B-ALL骨髓样本,揭示了肿瘤与免疫细胞互作的关键密码:其一,复发性B-ALL细胞高表达半乳糖凝集素9(galectin-9),这种蛋白可操纵免疫检查点,构建免疫逃逸屏障,为癌细胞构建了一张安全网,相当于复发癌细胞的"盾牌";其二,CAR-T细胞表面的TIM-3受体恰好与galectin-9精准结合,触发免疫抑制信号,使抗癌活性大幅削弱。这一"蛋白对话"如同癌细胞的"遥控开关",直接导致CAR-T细胞陷入"静默",从而使癌细胞得以持续存在。
利用TIM-3诱饵,重启CAR-T抗癌引擎的"钥匙"
这一关键发现为开辟一条新的防线打开了大门,阻断这种抑制信号可以重新激发CAR-T细胞对抗白血病的活性。
针对这一机制,科研团队开发出一种TIM-3诱饵(即TIM-3蛋白的可溶性版本),这种诱饵可特异性拦截galectin-9的抑制信号,却不干扰CAR-T细胞正常功能。在临床前研究中,经基因改造分泌该诱饵的CAR-T细胞,展现出双重突破:其一,抗白血病疗效显著提高;其二,抗癌效力维持时间大幅延长。
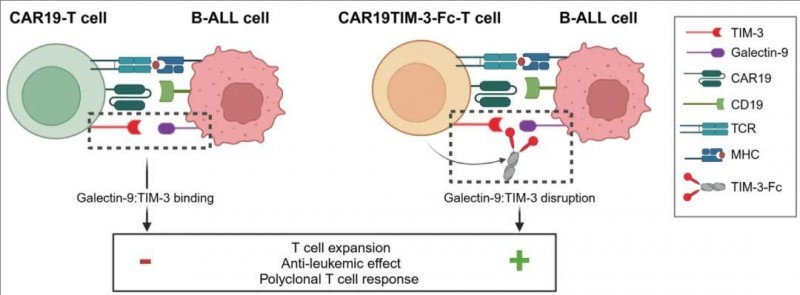
▲图源“Blood”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
从B-ALL到实体瘤的抗癌新征程
尽管这项研究尚处临床前探索阶段,却已为B-ALL治疗锚定了突破性方向。核心目标直指两大难题:提升CAR-T疗法的抗癌效力,同时降低疾病复发风险——这不仅是为患者争取"暂时缓解",更志在实现持久治愈,让CAR-T疗法从"应急方案"蜕变为守护生命的长效盾牌。
同时,鉴于恶性肿瘤在免疫逃逸机制上的共性特征,这项成果有望成为破局实体瘤治疗的关键支点,推动CAR-T技术跨越血液癌症的边界,向肺癌、肝癌等更复杂的抗癌战场进军,驱动癌症治疗加速迈向精准高效、长效可控的全新时代!
CD5 CAR-T细胞疗法首战告捷,44%总缓解率破局T淋巴瘤,2例患者达完全缓解
尽管靶向疗法持续迭代,原发性难治性或复发性(r/r)T细胞淋巴瘤(TCL)患者的生存现状仍不容乐观。为此,一种创新的自体CD5CAR-T细胞疗法应运而生——该疗法通过CD5靶向嵌合抗原受体(CAR),下调转导T细胞中的CD5蛋白水平以避免自相残杀,同时精准杀伤CD5+恶性细胞,为患者带来新希望。
值得振奋的是,近期全球知名《Blood》杂志公布了“首个非基因编辑的CD5.CAR-T细胞胞临床试验(NCT0308190)的惊艳数据”,主要针对复发/难治性(r/r)、CD5阳性的成熟T细胞淋巴瘤(TCL)患者,包括外周T细胞淋巴瘤(PTCL)、血管免疫母细胞性T细胞淋巴瘤(AITL)、HTLV-1相关成人T细胞白血病/淋巴瘤等。入组患者中位年龄63岁(29-71岁),既往接受过中位5线治疗(2-18线),均接受第二代自体CD5.CAR-T细胞治疗。
结果显示:在9例可评估疗效的患者中,总缓解率达到44%,其中2例患者达到完全缓解(CR),此外,随访发现,有2例患者在41个月和48个月时仍存活(详见下图)。

▲图源“Blood”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
值得关注的是,两例患者的治疗表现极具参考意义:
患者31是一位HTLV-1驱动的T细胞淋巴瘤(TCL)患者,颈部和纵隔受累面积较大,在接受CD5CAR-T细胞(DL3方案)治疗后,左锁骨上淋巴结肿大从11.8cm×8.8cm显著缩小至3.3cm×2.4cm,且正电子发射断层扫描-计算机断层扫描(PET-CT)显示代谢活性完全消失(详见下图),该患者获得部分缓解(PR)。
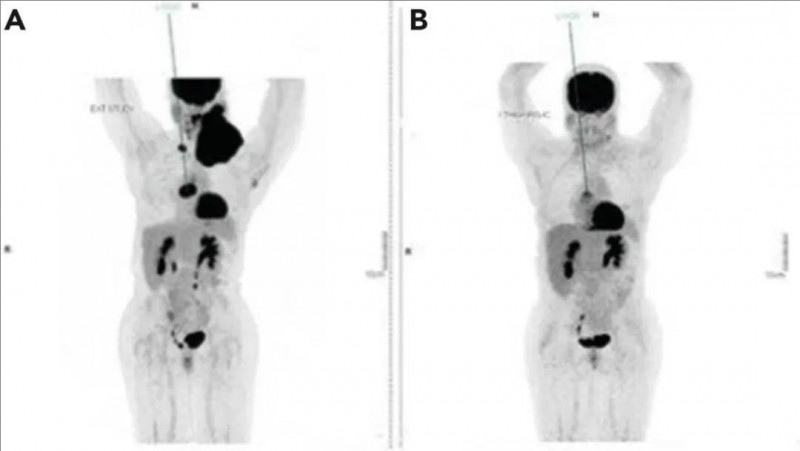
▲图源“Blood”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
患者5是一位血管免疫母细胞性T细胞淋巴瘤(AITL)患者,经CD5CAR-T细胞(DL3方案)治疗后,颈部及腋窝淋巴结肿大、多发性皮肤病变均出现临床消退,提示可能存在疾病反应。
但CD5CART细胞输注4周后PET-CT显示,高代谢淋巴结增多和皮下结节摄取增加,先前受累的淋巴结区域氟脱氧葡萄糖F18(FDG)活性显著升高;8周后复查PET/CT,除1处新病灶外,几乎先前所有的FDG-avid病灶均出现间歇性消退,呈现混合影像学反应(详见下图)。该患者经二次输注CD5CAR-T细胞+异基因造血干细胞移植(allo-HSCT)联合治疗后,达完全缓解(CR),并持续CR长达41个月。
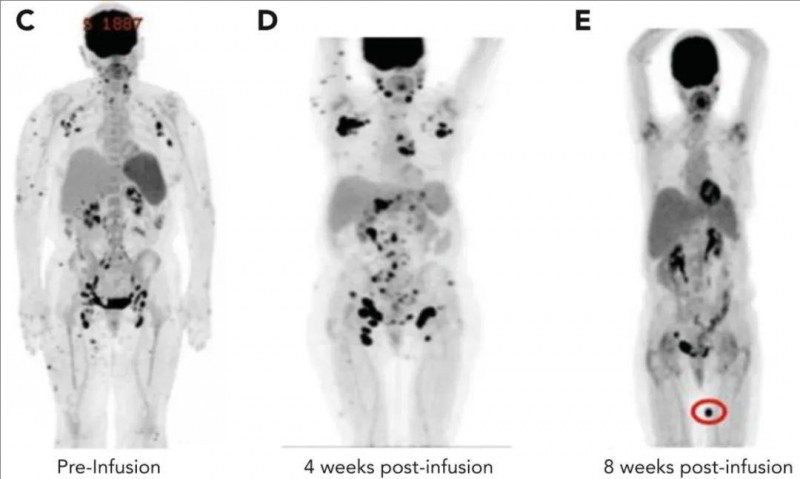
▲图源“Blood”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
综上,CD5.CAR-T细胞疗法在r/rCD5+TCL患者中展现出良好安全性与临床活性,未引发内源性T细胞耗竭或严重感染。初步数据支持其作为潜在治疗策略,后续需扩大样本及长期随访验证。
GCC19 CAR-T细胞火力全开,转移性结直肠癌中位总生存时间逼近2年
《美国医学会肿瘤学杂志》刊载了一项“应用GCC19 CAR-T细胞,治疗转移性结直肠癌1期临床研究”的令人鼓舞的结果。本次共纳入15例中位年龄为44岁(范围:33-61岁)的转移性结直肠癌(mCRC)患者,给予GCC19(鸟苷酸环化酶-C)CAR-T治疗。
结果显示:客观缓解率(ORR)达40%,总体临床受益率更是高达73%。其中40%(6例)的患者达到部分缓解(PR),另外5例患者的最佳反应为病情稳定(SD)。
此外,截至数据数据统计时止,中位总生存期(OS)长达22.8个月(95%CI,13.4-26.1);接受较高剂量治疗的患者的中位无进展生存期(PFS)显著高于接受较低剂量治疗的患者,中位PFS分别为6.0个月(高剂量组) vs 1.9个月(低剂量组)(详见下图)。
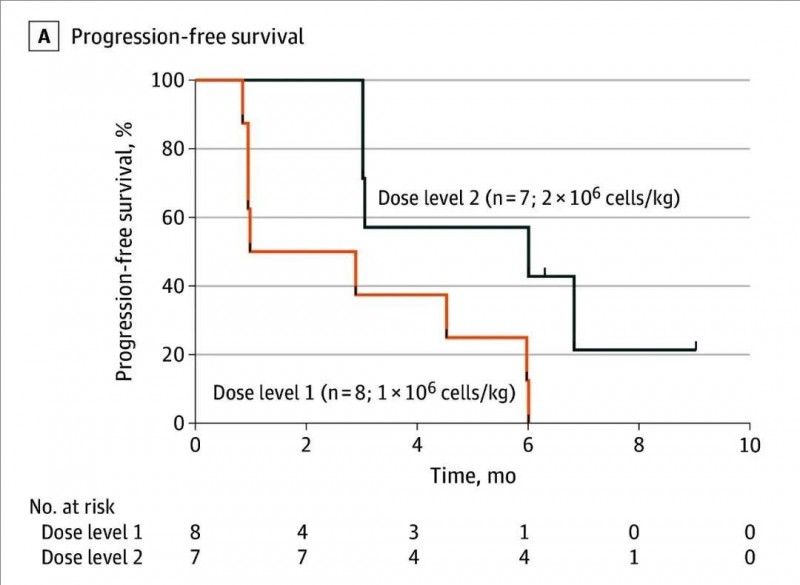
▲图源“JAMA Oncol”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
值得一提的是,其中一位接受GCC19 CAR-T治疗后,达到部分缓解(PR)的患者(患者1),在治疗前、治疗1个月、3个月和6个月时复查影像学检查(CT、FDG-PET)显示:治疗后该患者转移性病灶明显改善(详见下图)。
▼患者1接受CAR-T细胞输注前后的影像学变化
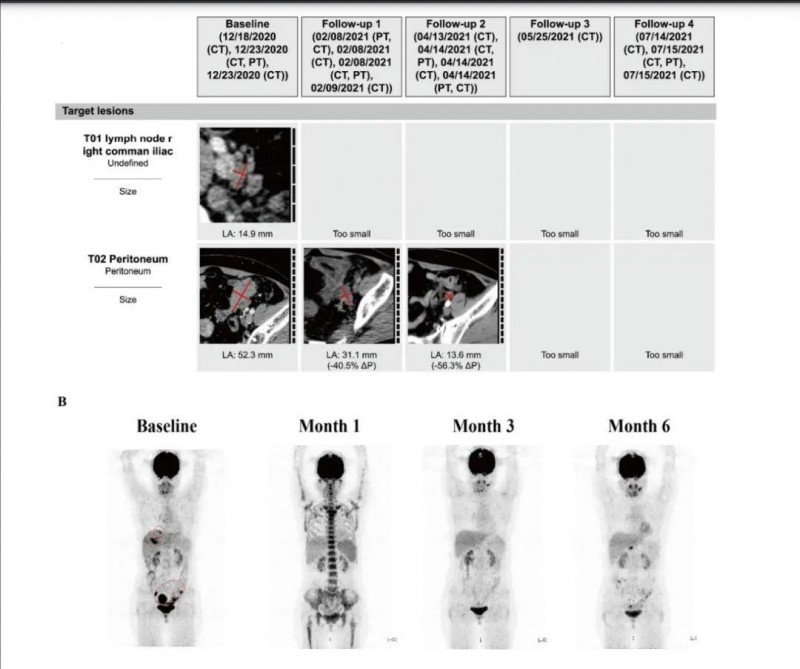
▲图源“JAMA Oncol”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
注:
①CT成像显示:腹部和骨盆目标病变显示部分反应(红色垂直线),非目标病变退行(未示出)。
②FDP-PET(氟脱氧葡萄糖-正电子发射断层扫描)放射成像显示:肝和盆腔转移灶(基线,红色圆圈),在治疗后显示部分代谢反应,观察到微弱的FDG摄取。
C-CAR031 CAR-T为晚期肝癌患者开辟生存新路径,疾病控制率突破90%
C-CAR031是一款针对GPC(肝癌黄金靶标)的CAR-T细胞疗法。2024年美国临床肿瘤学会(ASCO)上,公布了C-CAR031治疗晚期不可切除的肝细胞癌(HCC)的1期惊艳数据!本次研究共入组24例晚期(BCLC C 期)肝细胞癌(HCC)患者,其中83.3% (20/24)的患者伴肝外转移,先前治疗的中位数为 3.5(范围 1-6)。几乎所有患者(95.8%,23名)都接受了免疫检查点抑制剂(ICI)和酪氨酸激酶抑制剂(TKI)治疗,入组接受4 个剂量水平 (DL) 的 C-CAR031 输注。
结果显示:全部入组患者的疾病控制率(DCR)高达90.9%,客观缓解率 (ORR)达50.0%(详见下图)。在22例可评估疗效的患者中,90.9% 的患者出现肿瘤缩小,不仅肝内病变,而且肝外病变,中位缩小率高达44.0%(范围为3.4%-94.4%)。此外,经过5.82 个月的中位随访,Kaplan-Meier 估计的中位无进展生存期(PFS)为 4.27 个月(95% CI,2.86-8.90)(详见下图)。
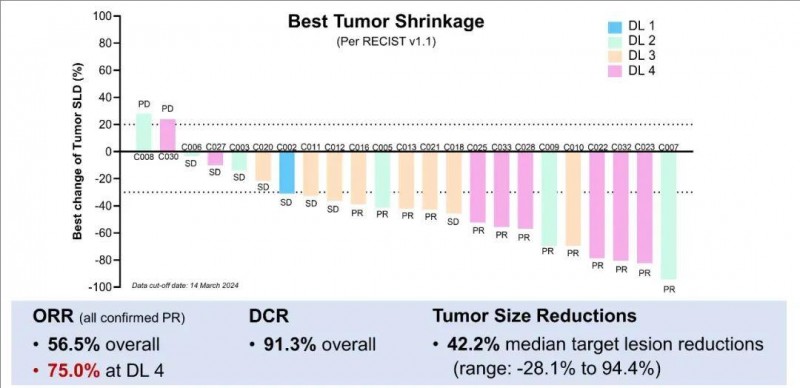
▲图源“ASCO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
下图展示了两位代表性患者(患者C023、患者C010),经过C-CAR031治疗后,均出现明显反应,肿瘤持续缩小。
C023号患者(DL = 4),从治疗1.5个月开始,在肺转移中表现出深度反应,可见肿瘤病灶明显缩小并减少。
▼C023号患者CAR-T治疗前后的影像学对比
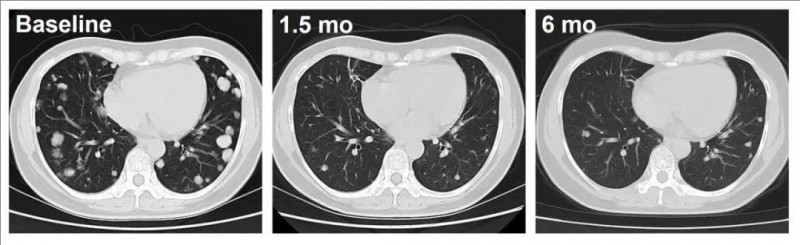
▲图源“ASCO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
C010号患者,在DL 3时,表现出长达12个月甚至更长时间的持久反应,可见肿瘤明显缩小。
▼C023号患者CAR-T治疗前后的影像学对比
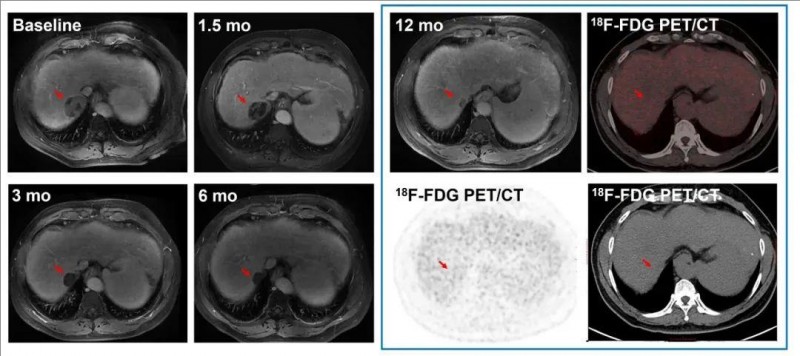
▲图源“ASCO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
百万疗法免费招募!中国成功研发多款CAR-T疗法,国内多家中心启动招募
曾经,CAR-T这项先进的治疗技术一直掌握在医疗水平发达的国家,很多病友在苦苦等待中遗憾离开。值得中国病友们振奋的是,“天价”疗法不再遥不可及,中国已成功研发出多款针对多款血液肿瘤及实体瘤的CAR-T疗法,并在国内多家知名癌症中心启动临床,很多晚期患者已通过我们,成功入组接受治疗!目前有多款CAR-T临床实验正在火热招募中,主要针对以下靶点及肿瘤类型:
在研癌种及靶点
目前有多款CAR-T临床实验正在火热招募中,主要针对以下靶点及肿瘤类型:
1)Claudin18.2:用于治疗胰腺癌、胃癌等;
2)C3:用于肝癌等治疗;
3)GUCY2C:用于结直肠癌的治疗;
4)PSMA:用于治疗前列腺癌等;
5)GPEGFRvII:用于治疗神经胶质瘤、头颈部肿瘤等;
6)CEA:用于治疗肺癌、胰腺癌、胃癌、乳腺癌、结肠癌等;
7)间皮素(mesothelin):用于治疗间皮瘤、胰腺癌、肺癌、卵巢癌等;
8)MUC-1:用于治疗胃癌、肝癌、肺癌、胰腺癌、结肠癌等;
9)B7-H3:用于治疗髓母细胞瘤、肾母细胞瘤、尤文肉瘤、神经母细胞瘤、横纹肌肉瘤、特别难以治疗的脑干肿瘤(DIPG)等。
10)BCMA:用于多发性骨髓瘤等治疗;
11)CD19:用于治疗白血病、淋巴瘤、B细胞急性淋巴细胞白血病等;
12)CD20:用于治疗淋巴瘤、弥漫大B细胞淋巴瘤、B细胞非霍奇金淋巴瘤等。
部分入组条件
1)自愿参加本研究并能够签署知情同意书;
2)筛选时年龄18〜70岁;
3)至少有1处可测量靶病灶(根据RECISTvl.l定义);
4)入选和治疗前世界卫生组织(WHO)/ECOG体能状态(PS)评 分为0或1分;
5)经超声心动图左室射血分数(LVEF)>45%;
6)肺部无活动性感染。
申请流程
做过基因检测的患者,可自行查看基因检测报告,一旦发现存在上述突变,可将近期病理报告、基因检测报告等资料汇总后,提交至医学部,初步评估是否有机会参加相关临床试验。一旦审核通过,有机会获得”天价“疗法免费治疗的机会。看不懂检测报告或想要明确相关靶点的患者,也可联系医学部,详细解读报告或了解检测详情。
我们的专家将为您全面分析解读检测报告,预计一个工作日内电话联系推荐用药方案,并匹配适合患者入组的临床试验项目。注:作为国内权威的肿瘤患者服务平台,我们承诺对所有受试者的个人信息保密,并保证在整个过程中,遵循国家临床研究相关的法律法规。
小编寄语
时至今日,CAR-T细胞疗法在血液系统恶性肿瘤的治疗领域已取得突破性进展,众多患者从中受益。然而,在癌症复发及实体瘤治疗方面,仍存在一定局限性。这主要是因为癌细胞具有免疫逃逸特性,加之实体瘤内部细胞浸润程度较低,同时免疫抑制性的肿瘤微环境也在从中作梗,阻碍了CAR-T细胞疗法充分发挥作用。令人欣慰的是,近年来全球的研究人员从未停止探索的脚步,持续钻研各种新型策略,致力于降低肿瘤抗原异质性,打破免疫抑制的困境,为癌症患者带来更多希望!
想寻求CAR-T细胞或国内外其他前沿抗癌技术(如TIL、TCR-T、NK细胞、益生菌等)的患者,可将出院小结、详尽的病理报告、治疗经历等资料,提交至医学部,进行初步评估或申请国内外抗癌专家会诊。
参考资料
[1]Falgàs A,et al.A TIM-3-Fc decoy secreted by engineered T cells improves CD19 CAR-T cell therapy in B-cell acute lymphoblastic leukemia[J]. Blood Journal, 2025: blood. 2024025440.
https://ashpublications.org/blood/article/doi/10.1182/blood.2024025440/536098/A-TIM-3-Fc-decoy-secreted-by-engineered-T-cells
[2]Hill LC,et al.Antitumor efficacy and safety of unedited autologous CD5.CAR T cells in relapsed/refractory mature T-cell lymphomas. Blood. 2024 Mar 28;143(13):1231-1241.10.1182/blood.2024026457. PMID: 38145560; PMCID: PMC10997912.
https://pmc.ncbi.nlm.nih.gov/articles/PMC10997912/
[3]Chen N,et al.Chimeric Antigen Receptor T Cells Targeting CD19 and GCC in linkstatic Colorectal Cancer: A Nonrandomized Clinical Trial. JAMA Oncol. 2024 Sep 19:e243891.
https://pmc.ncbi.nlm.nih.gov/articles/PMC11413756/
[4]Zhang Q,et al.Phase I study of C-CAR031, a GPC3-specific TGFβRIIDN armored autologous CAR-T, in patients with advanced hepatocellular carcinoma (HCC)[J]. 2024.
https://meetings.asco.org/abstractspresentations/234377
