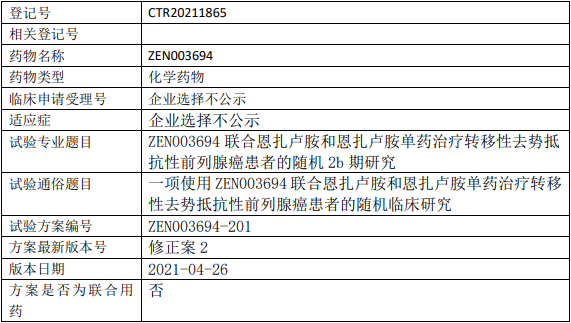
恒翼生物ZEN003694临床试验,ZEN003694联合恩扎卢胺和恩扎卢胺单药治疗转移性去势抵抗性前列腺癌的IIb期临床试验
试验目的
主要目的
通过盲态独立中心阅片对队列A患者,评估试验药联合恩扎卢胺与恩扎卢胺单药对其rPFS影响。
次要目的
1、通过盲态独立中心阅片对所有患者,评估试验药联合恩扎卢胺与恩扎卢胺单药对其rPFS影响;
2、通过研究者对所有患者,评估试验药联合恩扎卢胺与恩扎卢胺单药对其rPFS影响;
3、通过研究者对所有患者,评估试验药联合恩扎卢胺与恩扎卢胺单药对其复合PFS影响;
4、提供每个治疗组从随机分组之日起的中位OS估算值(所有患者);
5、比较试验药联合恩扎卢胺与恩扎卢胺单药的PSA50缓解率(所有患者);
6、根据RECIST1.1标准评估试验药与恩扎卢胺联合治疗在研究入组时具有RECIST可测量病灶的mCRPC患者中的ORR;
7、通过患者报告的健康状况和生活质量,评估试验药联合恩扎卢胺对mCRPC患者的影响;
8、评估试验药联合恩扎卢胺与恩扎卢胺单药从随机到开始化疗的时间;
9、评估试验药联合恩扎卢胺与恩扎卢胺单药首次SRE的时间;
10、定量潜在人群PK分析中ZEN003694、ZEN003791、恩扎卢胺及N-去甲基恩扎卢胺的血浆浓度。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:平行分组
随机化:随机化
盲法:开放
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男
健康受试者:无
出入排标准
入选标准
1、男性,年龄≥18岁。
2、转移性、去势抵抗性且经组织学确认的前列腺癌。
3、筛选前8周及以上进行了去势手术或连续药物去势;在首次给药前的4周内确认血清睾酮<50ng/dL。
4、根据PCWG3标准,在先前的阿比特龙治疗后出现进展。
5、研究者认为不适合化疗的患者或拒绝化疗的患者。
6、仅限队列A-患者必须满足以下对阿比特龙反应较差定义的任一条:
a.阿比特龙对激素敏感性前列腺癌(HSPC)患者开始治疗:服用阿比特龙持续时间<12个月,或在服用阿比特龙时未达到0.2ng/mL的PSA最低点;
b.阿比特龙对去势抵抗性前列腺癌(CRPC)患者开始治疗:服用阿比特龙持续时间<6个月,或在服用阿比特龙时无法达到PSA50缓解。
7、仅限队列B-患者必须满足以下对阿比特龙有反应定义的任一条:
a.阿比特龙对激素敏感性前列腺癌(HSPC)患者开始治疗:服用阿比特龙持续时间≥12个月,且最低点PSA<0.2ng/mL;
b.阿比特龙对去势抵抗性前列腺癌(CRPC)患者开始治疗:服用阿比特龙持续时间≥6个月,且PSA50缓解。
8、东部合作肿瘤小组(ECOG)的状态为0或1。
9、筛选时有合格的实验室参数,包括:
a.中性粒细胞绝对计数(ANC)≥1.5×109/L;
b.血小板计数≥100,000/mm3;
c.天冬氨酸氨基转移酶(AST)或丙氨酸氨基转移酶(ALT)≤3.0xULN(如果存在肝转移,则≤5xULN);
d.总胆红素≤1.5xULN(已知吉尔伯特综合症的受试者≤3.0xULN);
e.血清肌酐≤1.5xULN或计算得出的(Cockcroft-Gault公式)或测得的肌酐清除率≥50mL/min;
f.凝血酶原时间(PT)、国际标准化比率(INR)和部分凝血活酶时间(PTT)<1.5xULN。
10、每天最多可使用10mg泼尼松或同等剂量的全身性皮质类固醇,但前提是该剂量在首次服用研究药物之前已稳定至少2周,并将在研究药物和恩扎卢胺给药期间保持稳定。
11、使用双膦酸盐或地诺单抗的患者必须在首次用药前至少4周保持稳定剂量。
12、患者必须是手术绝育的,或如果与有生育能力的女性伴侣有性生活,患者必须同意从筛选至研究药物末次给药后3个月内使用两种避孕方法(其中一种必须包括使用避孕套作为屏障避孕方法)。
13、有吞服胶囊并遵守研究流程的能力。
14、在开始任何研究流程之前能够理解并自愿签署知情同意书。
排除标准
1、有脑转移史,有癫痫发作史,有癫痫发作倾向的状况。
2、以前曾接受过BET抑制剂的研究(包括以前参与过本研究或ZEN003694的研究)。
3、既往接受过第二代雄激素受体(AR)抑制剂(例如恩扎卢胺、阿帕鲁胺、多拉米胺、普克鲁胺)。接受过第一代AR拮抗剂(例如比卡鲁胺、尼鲁米特、氟他胺)的不计入该标准。
4、既往接受过化疗的转移性去势抵抗性患者(既往接受化疗的激素敏感性患者允许入组,但前提是最后一次化疗的时间至少为首次研究用药的6个月前)。
5、在首次服用研究药物之前的2周或5个半衰期中(以时间更短者为准)已接受过既往的全身性抗癌治疗。
6、自阿比特龙停药以来已接受外源性睾酮治疗。
7、在进入研究之前,与既往的全身性治疗相关的毒性(不包括脱发和神经病变)未能恢复至1级或更低水平。
8、首次服用研究药物前2周内进行放射治疗。
9、在首次服用研究药物前的6周内进行骨靶向放射性核素治疗。
10、当前正在接受细胞色素(CYP)2C8的强抑制剂,CYP3A4的强诱导剂或抑制剂以及治疗窗较窄的CYP1A2、CYP3A4、CYP2C9和CYP2C19的底物;在首次服用研究药物之前至少7天必须停用强诱导剂、抑制剂和底物。
11、三次检测的平均QTcF间期>470毫秒。
12、已知的心脏功能受损或有临床意义的心脏病,例如无法控制的室上性心律失常,需要治疗的室性心律失常或充血性心力衰竭(纽约心脏协会功能性III级或IV级)。
13、首次服用研究药物前6个月内的心肌梗塞或不稳定型心绞痛。
14、其他有临床意义的合并症,例如不受控制的肺部疾病,活动性中枢神经系统疾病,需要全身治疗的活动性、无法控制的细菌、病毒或真菌感染,或可能影响安全性或患者参与研究的任何其他疾病。
15、胃肠功能受损,可能会明显改变ZEN003694或恩扎卢胺的吸收。
16、在进入研究时患有需要治疗的其他已知活动性癌症。除外非黑色素瘤皮肤癌、原位黑色素瘤、非肌层浸润性膀胱癌。
17、既往人类免疫缺陷病毒(HIV)呈阳性;或活动性乙型肝炎定义为HBVDNA病毒载量阳性或根据相关指南定义;或丙型肝炎病毒(HCV),除非经过治疗且无法检测到病毒载量。
18、在首次服用研究药物之前的4周内,接受过除了诊断性手术、牙科手术或支架手术以外的大手术。
19、先天性或其他血小板功能缺乏的病史,任何已知的先天性或获得性凝血病,包括使用香豆素。允许使用直接口服抗凝剂(例如阿哌沙班、利伐沙班)和低分子肝素。
20、同时参加另一项临床研究治疗试验。
21、研究者认为会阻止患者完成研究或遵循研究计划的任何其他原因。
