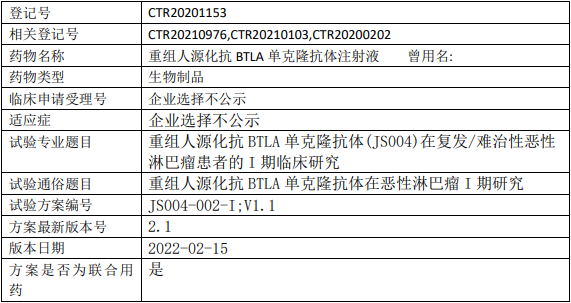
君实生物/君盟生物/众合生物JS004临床试验,重组人源化抗BTLA单克隆抗体(JS004)治疗复发/难治性的恶性淋巴瘤的I期临床试验
试验目的
1、评价JS004注射液单药及联合特瑞普利单抗治疗复发/难治性恶性淋巴瘤患者的安全性和耐受性;
2、观察JS004注射液单药及联合特瑞普利单抗在复发/难治性恶性淋巴瘤患者中的剂量限制性毒性(DLT),并确定最大耐受剂量(MTD)和Ⅱ期推荐剂量(RP2D)。未观察到MTD时,取方案规定的JS004最高剂量为最大可行剂量(MFD)。
试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至70岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、理解并自愿签署知情同意书
2、病理学确诊的恶性淋巴瘤
3、复发/难治患者,包括:
1)自体干细胞移植后复发进展者;
2)无法进行自体干细胞移植者,须经系统性二线治疗失败,包括无效(SD或者PD),或者复发进展;
3)B细胞淋巴瘤患者,既往须使用过利妥昔单抗
4、ECOG:0~1
5、预期生存期≥12周
6、至少一个符合2014版Lugano评效标准要求的可测量病灶
7、自愿知情同意提供治疗前新鲜活检样本,对于无法提供治疗前新鲜活检样本的患者,可提供2年内存档样本
8、重要器官的功能符合方案规定的相关实验室检查标准
9、育龄期女性患者,以及伴侣为育龄期女性的男性患者,需要在研究治疗期间和研究治疗期结束后3个月内采用一种经医学认可的避孕措施(如宫内节育器IUD、避孕药或避孕套);育龄期女性患者在研究入组前的7天内血清或尿HCG检查必须为阴性;而且必须为非哺乳期
排除标准
1、已知对大分子蛋白质制剂或JS004组成成分过敏的患者
2、既往接受过抗BTLA或抗HVEM抗体治疗
3、JS004首次给药前4周内参加其他临床研究,除非是观察性(非干预性)临床研究或干预性研究的随访期
4、JS004首次给药前4周内接受重大手术(由研究者判断)或正处于手术恢复期。JS004首次给药前4周内抗肿瘤化疗(亚硝基脲或丝裂霉素末次化疗需待6周)、放疗、激素治疗、靶向治疗、免疫治疗或生物治疗。JS004首次给药前2周内接受有抗肿瘤适应症的中药或中成药制剂。可接受激素治疗非肿瘤相关疾病(如胰岛素治疗糖尿病以及激素替代疗法等)。不影响疗效评价前提下,可接受对孤立病灶的局部姑息性治疗(如局部手术或放疗)
5、因免疫相关不良反应而中止既往免疫治疗的患者
6、JS004首次给药前4周内使用过免疫抑制药物,但皮质类固醇喷鼻剂、吸入剂或≤10mg/日全身性泼尼松及相当用量同类药物治疗除外
7、既往接受过异体骨髓移植或实体器官移植
8、JS004首次给药前30天内接种减毒活疫苗
9、JS004首次给药前5年内患有两种及两种以上恶性肿瘤。已根治的早期恶性肿瘤(原位癌或Ⅰ期肿瘤)除外,如充分治疗的宫颈原位癌、基底细胞或鳞状上皮细胞皮肤癌
10、存在症状性、未治疗或需要接受持续治疗(包括皮质类固醇和抗癫痫药)的中枢神经系统(CNS)转移。既往接受治疗者,入组前临床稳定至少4周、排除新发或扩大转移证据并停用类固醇治疗的,可以入组
11、既往抗肿瘤治疗后毒性未缓解,即未消退至基线、NCI-CTCAE5.0规定的0~1级(除脱发外)或入选/排除标准中规定的水平。合理预期不会被研究药物加重的不可逆毒性(如听力损失),与医学监查员协商后可以入组
12、在过去2年内需要全身治疗的活动性自身免疫性疾病(如使用疾病调节剂、皮质类固醇或免疫抑制药物),包括但不限于(如:系统性全身性红斑狼疮、多发性硬化症、类风湿性关节炎、炎症性肠病、自身免疫性甲状腺疾病、血管炎、银屑病,等)。但仅使用激素替代疗法可控制的甲状腺、肾上腺或垂体功能减退,Ⅰ型糖尿病,无需系统治疗的银屑病或白癜风等,可以参加本研究;
13、存在速发过敏反应、外用皮质类固醇无法控制的湿疹或哮喘病史
14、存在原发性免疫缺陷病史
15、合并无法控制的伴随疾病,包括但不限于:持续的或活动性感染、原因不明的发热>38.5°C(肿瘤性发热受试者由研究者判断是否纳入研究)、根据纽约心脏病协会(NYHA)心功能分级≥3的症状性充血性心力衰竭、不受控的高血压、不稳定型心绞痛、心律失常、活动性消化性溃疡病或胃炎
16、既往或当前存在活动性肺结核、药物诱导性间质性肺病或间质性肺炎
17、存在活动性炎症性肠病史(如克罗恩氏病或溃疡性结肠炎)
18、已知人类免疫缺陷病毒(HIV)阳性患者
19、存在乙型肝炎病毒(HBV)或丙型肝炎病毒(HCV)感染证据的患者。HBsAg阳性,或既往HBV感染者HBcAb阳性且HBsAg阴性经治疗后,HBVDNA拷贝数小于所在研究中心正常值上限者;既往HCV感染者筛选期HCVRNA检测结果阴性者,可以参加本研究
20、妊娠或哺乳期女性
21、合并白癜风、脱发和经激素替代治疗已控制的内分泌缺陷的患者,如甲状腺功能减退症等,可以入组。合并类风湿性关节炎和其他关节病、舍格林综合征、局部用药后已控制的乳糜泻和银屑病的患者,以及抗核抗体(ANA)、抗甲状腺抗体等血清学检查阳性的患者,应评估靶器官是否受累及是否需要全身性治疗,由研究者决定是否入组
22、经研究者判断存在可能影响受试者权益、安全、依从性、签署知情同意能力及影响研究结果解读的任何其他医学(如呼吸、代谢、先天性、内分泌或者中枢神经系统疾病等)、精神或社会因素
23、有相关临床症状(呼吸困难,喘憋,腹胀等),未控制或者需要反复进行引流的胸腔/腹腔积液,或心包积液的患者;
24、具有精神类药物滥用史且无法戒除者或有精神障碍史者。
