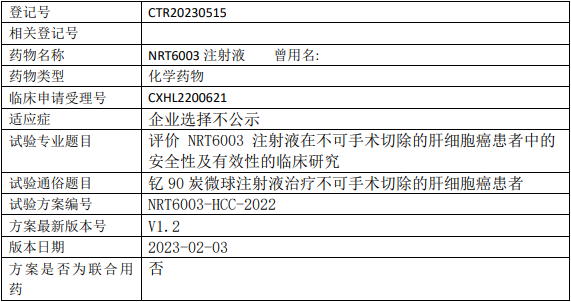
成都纽瑞特NRT6003临床试验,评价钇90微球NRT6003注射液治疗不可手术切除的肝细胞癌安全性及有效性的I期临床试验
试验目的
1、评价NRT6003注射液在不可手术切除的肝细胞癌患者中的安全性及有效性;
2、探索NRT6003注射液给药后钇[90Y]炭微球在人体的分布特征。
试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、自愿加入本研究,并签署知情同意书;
2、经临床、影像和/或病理学诊断为肝细胞癌(根据卫健委《原发性肝癌诊疗指南(2022年版)》);
3、经研究者评估为目前不可以手术切除/消融,或研究者认为存在其他原因不适合手术切除/消融,或受试者拒绝手术切除/消融;
4、在对比增强MRI或CT影像中,至少有1处可依据mRECIST标准测量的病灶;
5、肝功能ChildPugh评分≤7分;
6、美国东部肿瘤协作组体能状态评分(ECOG)≤1分;
7、依据肝脏总体积,肿瘤负荷≤50%;
8、有足够的器官功能:
①血常规(签署知情同意书前14天内未接受过输血或集落刺激因子(G-CSF治疗):绝对中性粒细胞计数(ANC)≥1.5×109/L;血小板计数(PLT)≥80×109/L;血红蛋白含量(HGB)≥90g/L;
②肝功能:血清总胆红素(TBIL)≤2倍正常上限(ULN);丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)≤5.0×ULN;白蛋白>30g/L;
③肾功能:肌酐(Cr)≤1.5×ULN;肌酐清除率(CCr)≥50mL/min(根据CockcroftGault公式计算);
④凝血功能:国际标准化比率(INR)、凝血酶原时间(PT)和活化部分凝血活酶时间(APTT)≤1.5×ULN。如受试者服用华法林或肝素进行抗凝治疗,需确定在停药或未用药时满足方案要求;
⑤心血管功能:心脏彩超检查:LVEF(左室射血分数)≥50%;
9、育龄女性和男性必须同意在签署知情同意后、研究期间及试验结束后6个月内采取严格的有效的避孕措施,男性在此期间禁止捐献精子,育龄期的女性受试者筛选期及给药前24h复查的妊娠试验结果必须为阴性。
排除标准
1、出现肝外转移或合并肝癌以外的恶性肿瘤;
2、伴有肝脏影像学癌栓(癌栓局限于肝段、肝叶范围内除外);
3、肝动脉畸形无法插管的患者;
4、对对比剂、麻醉剂过敏;
5、严重的肺功能不全(一秒率,FEV1/FVC<50%或一秒钟用力呼气容积(FEV1)<50%预计值或每分钟最大通气量(MVV)<50L/min);
6、失代偿期肝硬化的临床表现(中度或以上腹水、上消化道出血、肝性脑病等);
7、伴有经积极治疗但仍未控制稳定的疾病,且经研究者判断可能影响试验药物安全性或有效性;
8、处于活动期或目前需系统治疗的严重感染;
9、人类免疫缺陷病毒抗体阳性;
10、预计生存期<3个月;
11、既往接受过放射治疗者或经肝动脉栓塞者(接受经肝动脉非碘化油化疗栓塞的患者由研究者判断是否可入组);
12、肝动脉造影和99mTc-MAA肝动脉灌注显像显示胃肠道分流,而这些分流可能无法通过血管介入技术纠正;
13、锝[99mTc]聚合白蛋白(99mTc-MAA动脉灌注显像)显示单次肺部辐射吸收剂量>30Gy;
14、给药前30天内曾接受抗肿瘤治疗或参加其他干预性临床试验;
15、妊娠或哺乳期女性;
16、研究者判断,存在既往抗肿瘤治疗引起的CTCAE≥2级的持续性未缓解的毒性反应(除外脱发)的患者;
17、任何研究者认为患者不适合参加本试验的其他原因。
