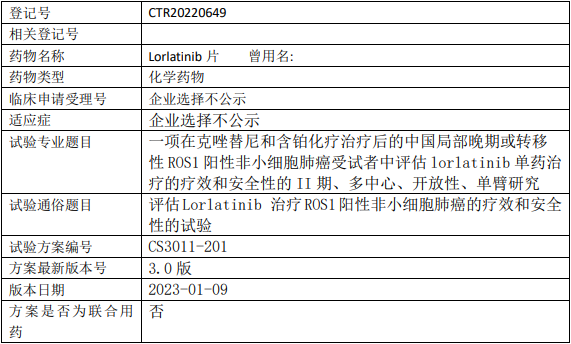
基石药业劳拉替尼临床试验,评估劳拉替尼(Lorlatinib、洛拉替尼)片治疗ROS1阳性非小细胞肺癌疗效和安全性的II期临床试验
试验目的
在接受克唑替尼和含铂化疗治疗后的局部晚期或转移性ROS1阳性非小细胞肺癌(NSCLC)受试者中,独立中心影像(ICR)根据实体瘤疗效评价标准1.1版(RECIST v1.1)评估的客观缓解率(ORR)来评估lorlatinib单药治疗的抗肿瘤作用。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至 无上限 (最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、经组织学或细胞学确诊为ROS1基因重排阳性的局部晚期或转移性NSCLC受试者。
2、受试者接受克唑替尼作为唯一的ROS1抑制剂治疗后影像学确证的疾病进展。
3、受试者针对疾病局部晚期/转移阶段接受至少1个周期的含铂化疗方案且有影像学确证的疾病进展。
4、开始研究治疗前,接受小分子抗癌治疗的受试者必须完成治疗≥5个半衰期;接受抗体治疗的受试者必须完成治疗≥3周。
5、至少存在1个根据RECIST v1.1确定的可测量靶病灶(包括颅内和颅外)。
6、美国东部肿瘤协作组体力状态(ECOG PS)0、1或2。
7、年龄≥18岁。
8、根据实验室检查结果评估,受试者必须有适当的器官功能。
9、既往放疗和化疗的急性影响恢复至基线水平严重程度或美国国家癌症研究所(NCI)不良事件通用术语标准(CTCAE 5.0)级别为1级,研究者认为不会对受试者构成安全风险的AE除外。
10、筛选时血清妊娠试验(针对具有生育能力的女性)阴性。
11、个人在知情同意书上签字并注明日期,表明受试者(或合法代表人)已被告知研究的所有相关信息。
12、愿意并能够遵循研究计划的访视、治疗计划、实验室检查和其他程序。
排除标准
1、入组前受试者针对疾病局部晚期/转移阶段接受超过1种化疗方案。
2、受试者所患癌症存在除ROS1以外的已知的主要驱动基因改变。
3、受试者在首次用药前4周内接受大手术。
4、受试者在首次用药前2周内接受放疗。姑息放疗必须在首次用药前至少48小时完成。立体定向或部分脑部放疗必须在首次用药前至少2周完成。全脑部放疗必须在首次用药前至少4周完成。
5、脊髓压迫,除非受试者通过治疗达到良好的疼痛控制,且首次用药前4周内神经系统功能完全恢复。
6、胃肠道异常,包括不能服用口服药物;需要静脉内营养;既往手术操作影响吸收,包括全胃切除或胃束带手术;活动性炎症性胃肠道疾病、慢性腹泻、症状性憩室病;过去6个月内治疗活动性消化性溃疡疾病;吸收不良综合征。
7、已知既往或怀疑对研究药物或制剂中的任何成分产生重度超敏反应;已知既往接受过lorlatinib治疗。
8、有严重的急慢性感染
9、有临床意义的心血管(动脉和静脉)和非血管心脏疾病(活动性或首次用药前3个月内)。
10、首次用药前一个月经研究者判断受试者有急性胰腺炎的易感特征,包括但不限于未控制的高血糖、当前胆结石症。
11、广泛播散性、双侧或存在3/4级间质性纤维化或间质性肺疾病病史,包括非感染性肺炎、过敏性肺炎、间质性肺炎、间质性肺疾病、闭塞性细支气管炎和肺纤维化。
12、在首次用药前过去3年内活动性恶性肿瘤的证据。
13、在首剂研究用药给药前12天内伴随使用方案规定的禁止使用的任何食物或药物。
14、可能增加与研究参与或研究药品使用有关的风险,或者可能干扰研究结果判读和可能使受试者不适合参加本研究的其他严重急性或慢性医学或精神疾病或者实验室检查异常。
15、入组研究前2周内和/或在研究期间参加涉及研究性药物的其他研究。
16、妊娠期女性受试者;哺乳期女性受试者。
