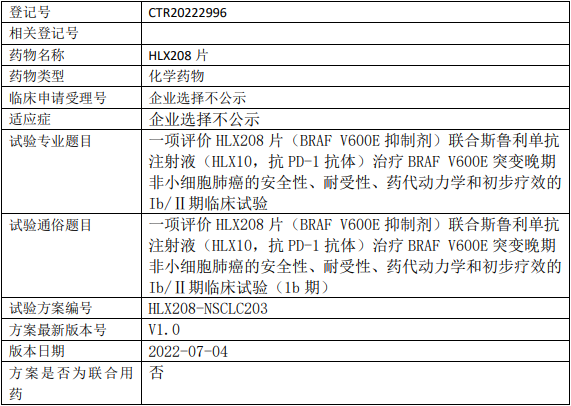
复宏汉霖HLX208临床试验,评价BRAFV600E抑制剂HLX208片联合斯鲁利单抗注射液(HLX10)治疗BRAFV600E突变晚期非小细胞肺癌安全性、耐受性、药代动力学和初步疗效的Ib/Ⅱ期临床试验
试验目的
Ib期主要目的
评价HLX208片联合斯鲁利单抗治疗BRAFV600E突变的晚期实体瘤受试者的安全性和耐受性,并探索最大耐受剂量(MTD),确定Ⅱ期临床试验推荐剂量(RP2D)。
Ⅱ期主要目的
BRAFV600E突变的非小细胞肺癌(NSCLC)受试者中初步评价HLX208片联合斯鲁利单抗的抗肿瘤疗效。
Ib期次要目的
1、评价HLX208片联合斯鲁利单抗的药代动力学(PK)特征;
2、初步评价HLX208片联合斯鲁利单抗的抗肿瘤疗效。
Ⅱ期次要目的
1、评价HLX208片联合斯鲁利单抗的安全性和耐受性;
2、评价HLX208片联合斯鲁利单抗的PK特征。
Ⅱ期探索性目的
II期评估潜在的预测生物标志物。
试验设计
试验分类:安全性和有效性
试验分期:其它其他说明:1b/II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至80岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄≥18周岁,且要求Ib期不超过75周岁,II期不超过80周岁,性别不限。
2、受试者须在验前对本研究知情同意,自愿入组并签署书面的受试者须在验前对本研究知情同意,自愿入组并签署书面的愿意遵守方案规定的所有研究程序和则。
3、Ib期经组织学或细胞确诊的不可切除转移性恶实体肿瘤受试者。II期经组织学或细胞确诊的转移性非小肺癌受试者。
4、研究中心或实验室检测明确存在BRAFV600E突变:
1)受试者在研究中心[包括研究者认可的第三方检测实验室]使用PCR或NGS方法检测为相应突变的受试者可入组;
2)II期所有入组受试者所有入组受试者必须进行中心实验室检测或者复测。
5、研究中心或实验室检测PD-L1阳性(TPS或者TC≥1%):
1)受试者在研究中心[包括研究者认可的第三方检测实验室包括研究者认可的第三方检测实验室]为TPS或者TC≥1%受试者可入组;
2)II期所有入组受试者必须进行中心实验室检测或者复测.
6、Ib期:既往经标准治疗失败(若为NSCLC受试者定义为标准治疗含铂化疗双药和免疫检查点抑制剂[ICI]失败)、或不耐受标准治疗或尚无标准治疗方案、或现阶段不适合标准治疗。Ⅱ期:既往至少经一线标准治疗失败、或不耐受一线标准治疗。
7、既往系统性抗肿瘤治疗(如化疗、放疗、靶向药物或有抗肿瘤适应症的中药等)结束距本研究首次用药须≥2周,免疫治疗须≥4周,姑息放疗在首剂研究药物之前须≥1周,且治疗引起的AE恢复至CTCAEv5.0≤1级(除外脱发)。
8、ECOG体力评分0-1分。
9、预计生存时间3个月以上。
10、受试者同意提供足够的既往储存的肿瘤组织标本或同意进行活检采集肿瘤组织和血样以进行BRAFV600E突变(必须有)、PD-L1表达(必须有)、CRAF、PTEN、RAS、MEK、NF1、PIK3CA、MSI、TMB、BRAFV600E突变丰度(尽可能提供)检测。注:建议提供首次研究用药前2年内,采集于非放疗部位,经福尔马林固定的肿瘤组织样本。石蜡包埋的肿瘤标本(首选),或福尔马林固定石蜡包埋(formalinfixedparaffnembed-ded,FFPE)肿瘤标本或未染色新切的连续组织切片(载玻片)。还必须提供上述标本的相关病理报告。新鲜采集标本、切除术、空心针芯活检、切除、切开、冲压或钳夹活检均在可接受范围内(首选新获得的组织)。不接受针吸样本(即缺乏完整的组织结构仅提供细胞悬液和/或细胞涂片的样本)、刷涂样本、来自胸腔或腹腔积液的细胞沉淀样本。组织样本和血液样本要求详见实验室操作手册。
11、对于实体瘤,根据RECIST1.1,经研究中心评估至少有一个可测量的肿瘤病灶(脑转移病灶不作为唯一可测量病灶)。注:可测量靶病灶不能选自既往放疗部位。如果既往放疗部位的靶病变是唯一一个可选靶病灶,研究者需提供显示该病灶明显进展的前后影像学数据。
12、研究用药首次用药前7天内实验室检查证实有充分的器官功能(在首次用药前14天内,未接受如输血、粒细胞集落刺激因子):
血液系统
●嗜中性粒细胞(ANC)1.5×109/L~9.5×109/L;
●血小板(PLT)≥80×109/L;
●血红蛋白(Hb)≥90g/L;
肝功能
●总胆红素(TBIL)≤1.5×正常值上限(ULN);
●谷氨酸氨基转移酶(ALT)≤2.5×ULN,肝转移受试者≤5×ULN;
●天门冬氨酸氨基转移酶(AST)≤2.5×ULN,肝转移受试者≤5×ULN;
肾功能
●肌酐(Cr)≤1.5×ULN,如>1.5×ULN,肌酐清除率需≥50ml/分钟(根据Cockcroft-Gault公式计算);
凝血功能
●活化部分凝血活酶时间(APTT)≤1.5×ULN;
●凝血酶原时间(PT)≤1.5×ULN;
●国际标准化比值(INR)≤1.5×ULN.
13、能够吞服并保留口服药物且不得存在任何可改变吸收的具有临床意义的胃肠道异常。
14、有生育能力的合格受试者(男性和女性)必须同意在试验期间和至HLX208片末次给药至少90天内,斯鲁利单抗末次给药后至少6个月内(以晚发生者为准)使用可靠的避孕方法(激素或屏障法或禁欲)。育龄期的女性受试者在入选前7天内的妊娠试验必须为阴性。
排除标准
1、II期:既往接受过BRAF抑制剂或MEK抑制剂治疗。
2、II期:既往接受过任何T细胞共刺激或免疫检查点治疗,如:CTLA-4、PD-1、PD-L1/2或其他靶向T细胞的药物。
3、已知存在EGFR突变或ALK重排(EGFR突变受试者既往接受过EGFR抑制剂治疗后疾病进展的除外)。
4、研究药物首次用药前28天内,接受过重大手术,本研究重大手术定义:术后至少需要3周恢复时间,才能够接受本研究治疗的手术。
5、首次使用研究药物前1周接受过CYP3A强抑制剂或强诱导剂治疗。
6、通过适当干预后无法控制的胸腔积液、心包积液或腹水。
7、有症状的脑转移(除非受试者接受治疗>3个月,首次用药前4周内影像结果无进展证据,无需类固醇激素治疗,且肿瘤相关的临床症状是稳定的)或脑膜转移。
8、患有活动性肺结核病。既往和目前有间质性肺炎、尘肺、放射性肺炎、药物相关肺炎、肺功能严重受损等可能会干扰可疑的药物相关肺毒性的检测和处理的受试者。
9、研究药物首次用药前14天内,出现任何需要系统性给予抗感染治疗的严重感染。
10、首次用药前两年内有其他恶性肿瘤病史,已治愈的宫颈原位癌或皮肤基底细胞癌除外。
11、乙型肝炎表面抗原(HBsAg)(+)或乙肝核心抗体(HBcAb)(+),同时乙肝病毒脱氧核糖核酸(HBV-DNA)≥2500拷贝/mL或500IU/mL,允许除干扰素以外的预防性抗病毒治疗。
12、HCV-RNA阳性(HCV抗体阳性者,需检测HCV-RNA,若HCV-RNA也阳性不可入组)。存在乙肝及丙肝共同感染的受试者需排除(HBsAg或HBcAb检查呈阳性,且HCV抗体检查呈阳性)。
13、HIV抗体检测阳性。
14、有严重的心脑血管疾病史:
1)研究药物首次用药前6个月内发生过脑血管意外(除外腔隙性脑梗塞、轻微脑缺血或短暂性脑缺血发作等)、心肌梗塞、不稳定心绞痛、控制不良的心律失常(包括QTc间期男性≥450ms、女性≥470ms)(QTc间期以Fridericia公式计算);
2)美国纽约心脏病协会(NYHA)心功能分级>II级或左室射血分数(LVEF)<50%。3)未控制的高血压(积极治疗后,收缩压>150mmHg和或舒张压>100mmHg).
15、研究药物首次用药前14天内或研究期间,需要使用皮质类固醇(>10mg/天泼尼松或等效剂量的同类药物)或其他免疫抑制剂进行系统治疗的受试者。在没有活动性自身免疫疾病的情况下,允许吸入或局部使用类固醇,或剂量≤10mg/天泼尼松疗效剂量的肾上腺激素替代。
16、存在已知活动性或可疑自身免疫病。但允许患有自身免疫相关甲状腺功能减退且接受甲状腺激素替代治疗的受试者参与研究。允许接受胰岛素治疗的经控制的1型糖尿病受试者参与研究。
17、已知有酒精或药物依赖。精神障碍者或依从性差者。
18、妊娠期或哺乳期女性。
19、首次给药前28天内使用过活疫苗。
20、研究者认为受试者存在任何临床或实验室检查异常或其他原因而不适合参加本临床研究。
