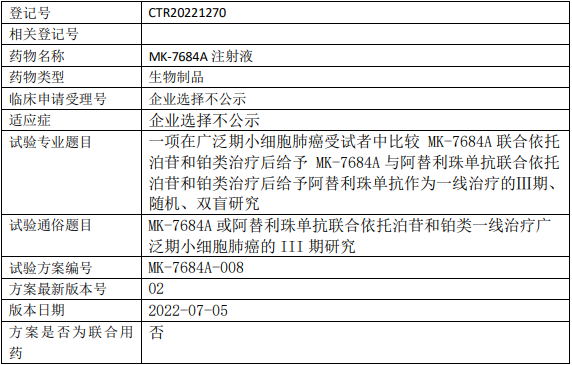
默沙东MK7684A临床试验,比较MK-7684A注射液联合依托泊苷和铂类治疗后给予MK-7684A与阿替利珠单抗联合依托泊苷和铂类治疗后给予阿替利珠单抗作为一线治疗广泛期小细胞肺癌的Ⅲ期临床试验
试验目的
在需要一线治疗的广泛期小细胞肺癌受试者中,比较MK-7684A注射液联合依托泊苷和铂类治疗后给予MK-7684A与阿替利珠单抗联合依托泊苷和铂类治疗后给予阿替利珠单抗的有效性和安全性。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、经组织学或细胞学确诊为ES-SCLC且需要一线治疗的受试者。
2、患有ES-SCLC,被定义为AJCC(第8 版) Ⅳ期(任何T,任何N,M1a/b/c),或者T3-4 由于肺部多发结节或者肿瘤/ 结节体积过大而不能被包含在一个可耐受的放疗计划中。
3、提供书面知情同意时年龄至少为18岁的男性或女性。
4、男性受试者同意采取避孕措施或者禁欲,不捐献精子
5、女性受试者未怀孕或母乳喂养,不是育龄女性,或者是育龄女性但采用了高效的避孕方法或者禁欲
6、受试者(或法定代表)提供研究的知情同意书。
7、根据RECIST 1.1评估,具有可测量的病灶。
8、提交存档的肿瘤组织样本或新获得的肿瘤样本。
9、随机分组前7天内的ECOG体能状态评分为0-1。
10、具有充分的器官功能。
11、预期寿命>3个月。
排除标准
1、由于严重、不受控制的医学疾病或非恶性的全身性疾病,被认为具有较差的医疗风险。
2、既往接受过SCLC治疗(全身性治疗,包括试验用药物、根治性放疗或根治性手术切除)。
3、预计在研究期间需要任何其他形式的SCLC抗肿瘤治疗。
4、在首次研究干预给药前30天内接种过活疫苗或减毒活疫苗。
5、当前正在参与或在首次研究干预给药前28天内参与过试验用药物研究或使用过试验性器械。
6、诊断为免疫缺陷或在研究药物首次给药前7天内正在接受长期全身性的类固醇治疗(每日剂量超过10 mg泼尼松等效剂量)或任何其它形式的免疫抑制治疗。
7、已知患有另一种恶性肿瘤,目前正在进展或过去3年内需要积极治疗。
8、已知有活动性的CNS转移和/或癌性脑膜炎。
9、对任何研究药物和/或其辅料有重度超敏反应史(≥3级)
10、过去2年内患有需要全身性治疗的活动性自身免疫性疾病(如,使用疾病调节剂、皮质类固醇或免疫抑制剂)。
11、有需要类固醇治疗的(非感染性)肺部炎症/间质性肺病病史或当前患有肺部炎症/间质性肺病。
12、有神经系统副瘤综合征病史或当前患有活动性的神经系统副瘤综合征。
13、有需要全身治疗的活动性感染。
14、已知有HIV感染史。
15、已知有乙型肝炎病史(定义为HBsAg反应性)或活动性丙型肝炎病毒(定义为检测到HCV RNA[定性])感染。
16、根据研究者的判断,受试者存在可能混淆试验结果、妨碍受试者参与全程试验或不符合受试者参加试验最佳利益的任何疾病、治疗或实验室异常的病史或当前证据。
17、有已知的精神疾病或药物滥用情况会妨碍受试者配合研究要求的能力。
18、既往接受过同种异体组织/实体器官移植。
19、研究干预首次给药前3周内接受过大手术,或在研究干预首次给药前尚未从手术和/或并发症中充分恢复。
20、有症状的腹水或胸腔积液。
