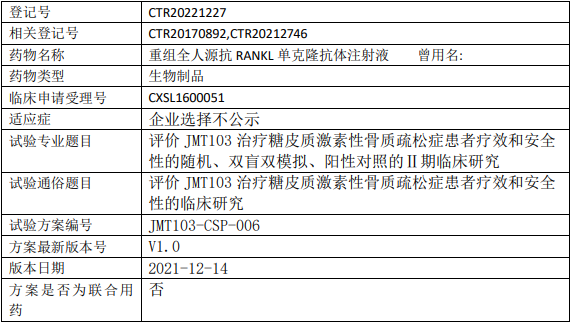
津曼特JMT103临床试验,评价JMT103注射液治疗糖皮质激素性骨质疏松症疗效和安全性的II期临床试验
试验目的
主要研究目的
评价JMT103治疗后第12个月腰椎骨密度(BMD)的变化
次要研究目的
1、评价JMT103治疗后第6个月腰椎骨密度变化评价JMT103治疗后第12个月全髋和股骨颈骨密度变化
2、评价JMT103对糖皮质激素性骨质疏松症患者的骨转换标志物的影响
3、评价JMT103治疗后第12个月对新发骨折的影响评价JMT103在糖皮质激素性骨质疏松症患者中的安全性评价
4、JMT103在糖皮质激素性骨质疏松症患者中的药物代谢动力学(PK)特征
5、评价JMT103的免疫原性
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、18岁或以上的男性和女性,有自主活动能力;
2、正在接受糖皮质激素治疗(泼尼松或相当量≥7.5mg/d)的患者,并且计划继续治疗,糖皮质激素总用药时长预计至少为6个月(受试者存在需使用激素的疾病包括但不限于:微小病变型肾病、局灶节段性肾小球硬化、膜性肾病、IgA肾病、狼疮性肾炎、抗中性粒细胞胞浆抗体(ANCA)相关性血管炎等);
3、筛选前糖皮质激素使用时间≥3个月,其中年龄小于40岁的患者需要有骨质疏松性骨折的病史;年龄≥40岁需满足以下任意一项:
a.筛选前存在骨质疏松性骨折病史,
b.年龄≥50岁的患者腰椎(L1-L4)或全髋骨密度(基于双能X线吸收检测法,DXA)符合T-值≤-2.0,
c.采用FRAX(使用激素剂量校正)预测接受激素治疗患者10年的主要骨质疏松性骨折风险≥10%(椎体、前臂、髋部、肩部),
d.采用FRAX(使用激素剂量校正)预测接受激素治疗患者10年的髋骨骨折风险>1%;
4、受试者必须存在至少2个腰椎椎体(L1-L4)可以进行DXA(双能X线吸收检测法)评估;
5、受试者能够和研究者保持良好的沟通并且遵守临床试验的各种要求,预计可以完成整个试验过程;
6、能充分知情并签署知情同意书。
排除标准
1、妊娠或哺乳期的女性;或具有生育能力的受试者拒绝在研究期间接受有效的医学避孕措施[自签署知情同意书至末次给药后6个月内];
2、既往或正患有颌骨骨髓炎或颌骨坏死;牙科手术或口腔手术伤口未愈合;需要口腔手术的急性牙或颌骨病;已计划在研究期间进行有创牙科手术者;
3、目前已入选其它临床研究,且末次用药距离研究给药日不足4周或5个消除半衰期(T1/2)(以时间长者为准);
4、最近5年内(从签署知情同意书算起)静脉使用过双膦酸盐、氟化物或锶剂治疗骨质疏松症;口服双膦酸盐治疗骨质疏松症(从签署知情同意书当日算起)者,符合以下条件之一应被排除:
a.累计使用大于或等于3年者;
b.累计使用大于3个月但小于3年,且最后1次用药在签署知情同意书之日前1年以内者(最后1次用药在签署知情同意书之日前1年或1年以上者可以入选、累计使用小于或等于3个月者可以入选);
5、筛选前6个月内使用过抗核因子κB活化因子配体(RANKL)抗体;
6、筛选前3个月内接受过影响骨代谢药物治疗者:
a.甲状旁腺激素(PTH)或PTH衍生物,例如特立帕肽;
b.促同化激素类或睾酮;
c.性激素替代治疗;
d.选择性雌激素受体调节剂(SERM),例如雷洛昔芬;
e.降钙素;
f.其他骨活性药物包括抗惊厥药物(苯二氮卓类除外)和肝素;
g.长期全身使用酮康唑、促肾上腺皮质激素(ACTH)、西那卡塞、铝、锂、蛋白酶抑制剂、甲氨喋呤、促性腺激素释放激素激动剂;
7、除外筛选前4周内使用过以下任意一种生物制剂(抗α4整合素抗体(如那他珠单抗)、抗、CD4/CD8T细胞(如阿法西普)、抗IL-12/IL-23(如优特克单抗)、CTLA4抑制剂(如阿巴西普)、IL1受体拮抗剂(如阿那白滞素)、IL6抑制剂(如托珠单抗)、抗CD20的单克隆抗体(如利妥昔单抗)、TNF拮抗剂(如阿达木单抗、赛妥珠单抗、戈利木单抗、依那西普、英夫利昔单抗);
8、存在需要使用>1种生物制剂治疗的潜在炎症性疾病(即受试者需要2种及以上生物制剂治疗,不包括JMT103);
9、存在除骨质疏松症以外的骨代谢性疾病:甲状旁腺功能减退/亢进症、成骨不全、恶性肿瘤、垂体功能减退症、高催乳素血症、肢端肥大症、佩吉特病(Paget)等;
10、甲状腺功能亢进或减退。对于稳定的(至少3个月)甲状腺激素替代治疗的甲状腺功能减退的受试者可以入选,排除满足以下条件者:
a.如果TSH水平低于正常范围,则受试者不能参加研究;
b.如果TSH水平升高(>5.5μIU/mL但≤10.0μIU/mL),应当测定血清FT4,如果血清FT4超出正常范围,受试者不能参加研究;
c.如果TSH水平>10.0μIU/mL,受试者不能参加研究;
11、吸收障碍综合征:吸收障碍综合征或与吸收障碍相关的各种胃肠道疾病,例如,克罗恩病和慢性胰腺炎;
12、肝病:
a.肝硬化;
b.不稳定的肝病(定义为有腹水、肝性脑病、凝血障碍、低白蛋白血症、食管或胃底静脉曲张,或持续黄疸);
c.已知的或经研究者判断有临床意义的胆道异常(Gilbert综合征、无症状的胆结石及胆囊息肉除外);
13、既往接受过器官或骨髓移植;
14、不愿在试验过程中按方案要求补充维生素D和钙;
15、未控制的并发疾病,包括但不限于:未控制的糖尿病(>2级,NCI-CTCAE5.0)、症状性充血性心力衰竭、高血压病(经标准治疗后血压仍≥150/90mmHg)、不稳定型心绞痛、需药物或仪器治疗的心律失常、既往6个月内的心肌梗塞病史且超声心动图显示左室射血分数<50%;
16、维生素D缺乏:25-(OH)vitaminD<20ng/mL。允许受试者补充维生素D5000IU/日,4-6周后进行一次复测,若复测25-(OH)vitaminD>20ng/mL可以入组;
17、血钙异常:当前低钙血症或高钙血症。血清钙或经白蛋白校正后的血清钙≤2.2mmol/L(8.8mg/dL)或≥2.9mmol/L(11.5mg/dL);在抽血用于血清钙筛查测定前的至少8小时内,受试者不得应用钙补充剂;
18、血清全段甲状旁腺激素(iPTH)>65pg/mL;
19、血液系统、肝肾功能、凝血系统检查符合以下条件者:血液系统(筛选期实验室检查前7天内未接受过输血或造血刺激因子等治疗):
中性粒细胞绝对值(ANC)<1.5×109/L;
血小板(PLT)<75×109/L;
血红蛋白(Hb)<90g/L;
肝功能:总胆红素(TBIL)>1.5×正常值上限(ULN),丙氨酸氨基转移酶(ALT)>2.5×ULN,天门冬氨酸氨基转移酶(AST)>2.5×ULN,(允许受试者2-4周后进行一次复测,若复测ALT/AST<2.5×ULN,可入选本研究);
肾功能:估算肾小球滤过率(eGFR)计算值<35L/min/1.73m2;*将采用CKD-EPI公式(慢性肾脏病流行病学协作公式)计算eGFR;
凝血功能:活化部分凝血活酶时间(APTT)>1.5×ULN;
国际标准化比值(INR)>1.5×ULN;
20、随机前7天内患有需要系统治疗的活动性细菌或真菌感染;
21、患者有HIV感染或活动性肝炎;已知存在活动性肺结核(TB)或怀疑有活动性TB者;
22、在筛选前5年内患有恶性肿瘤,但经治疗后预期可痊愈的肿瘤(如完全切除的原位皮肤基底细胞或鳞状细胞癌、宫颈癌或乳腺导管癌等)除外;
23、已知对JMT103处方、阳性对照药、钙及维生素D制剂具有变态反应或超敏反应或不耐受的;
24、存在阿仑膦酸钠片禁忌症,包括:导致食管排空延迟的食管异常,如食管狭窄或弛缓不能、不能站立或直坐至少30分钟;
25、影响双能X线吸收法测定骨密度的情况:可测量的腰椎椎体少于2个;身高、体重或腰围可能妨碍准确测量;严重脊柱侧弯等具有其他影响骨密度检测的情况;
26、研究者认为不适合入组本研究的受试者。
