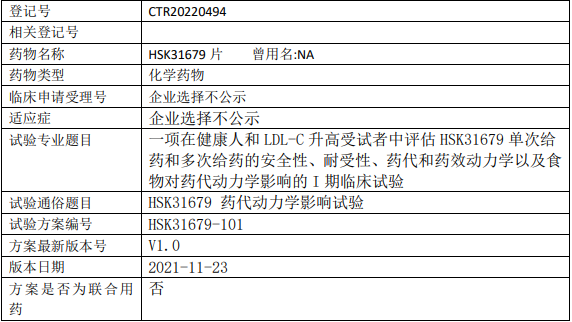
海思科HSK31679临床试验,评估HSK31679片在健康人和低密度脂蛋白胆固醇(LDL-C)升高的受试者中单次给药和多次给药的I期临床试验
试验目的
主要目的
在中国健康受试者和LDL-C升高(>100mg/dL)受试者中分别评估HSK31679单次给药和多次给药的安全性和耐受性。
次要目的
在中国健康受试者中和LDL-C升高(>100mg/dL)受试者中分别评估HSK31679单次给药和多次给药后的药代动力学(PK)特征。
评估HSK31679多次给药在联用或不联用他汀类药物的LDL-C升高受试者中对血脂水平的药效学(PD)影响。评价食物对HSK31679单次给药后药动学的影响。
评价HSK31679对QTc间期和其他心电图(ECG)参数(QT间期、PR间期、QRS间期和RR间期)的影响。
探索性目的
进行探索性物料平衡研究,考察血浆、尿液、粪便中HSK31679的原型和代谢产物的比例。
评估联用他汀类药物对HSK31679药代动力学(PK)的影响。
试验设计
试验分类:药代动力学/药效动力学试验
试验分期:I期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至60岁(最大年龄)
性别:男+女
健康受试者:有
出入排标准
入选标准
1.在进行任何与研究相关的活动之前,必须已签署书面知情同意书,且必须能够了解试验的全部性质和目的,包括可能存在的风险和不良反应;
2.筛选时,A部分SAD入选标准为年龄在18至55岁(含)之间,B部分MAD入选标准为年龄在18至60岁(含)之间,男女不限;
3.筛选时,BMI≥18.0且≤30.0kg/m2,体重≥45kg;
4.筛选时,空腹情况下,A部分SAD入选标准为LDL-C>70mg/dL(>1.8mmol/L),B部分MAD入选标准为LDL-C>100mg/dL(>2.59mmol/L);
5.筛选时,空腹情况下,甘油三酯TG<400mg/dL(<4.52mmol/L);
6.在筛选和第1天给药前,无具临床意义的异常,包括:
体格检查无任何异常且有临床意义的结果;
仰卧或静坐5分钟后的脉搏在50至100bpm范围内(含临界值),首次不达标的受试者允许复测,如果连续两次复测达标,则符合此标准,如果复测1次不达标则不再进行复测;
记录三次常规12-ECG(三次测量的平均值将用于确定是否合格),结果与正常的心脏传导和功能一致,包括:窦性心律,HR在50至100bpm(含)之间;使用Fridericia方法(QTcF)校正的QT间期,男性受试者在350至450毫秒(含)之间,女性受试者在350至470毫秒(含)之间;
QRS持续时间<120ms;PR间期≤210ms;
心电图形态正常,经研究者判断,无具临床意义的改变;
无长或短QT综合征的家族病史;
无尖端扭转型室性心动过速的风险因素或诊断史;
7.具有生育能力的男性和女性受试者须同意在研究期间和末次用药后6个月内采取适当的物理避孕措施。有效的避孕方法包括女性绝育(如双侧输卵管结扎术)、子宫内避孕器与屏障避孕(避孕套、子宫帽)等。
8.愿意且能够遵守所有研究评估并遵守方案时间表和限制条件。
9.SAD和MAD非他汀联用受试者附加纳入标准:仰卧或静坐5分钟后的收缩压在90至139mmHg范围内(含临界值),舒张压在60至89mmHg范围内(含临界值),首次不达标的受试者允许复测,如果连续两次复测达标,则符合此标准,如果复测1次不达标则不再进行复测;
10.MAD他汀联用受试者附加纳入标准:
1)仰卧或静坐5分钟后的收缩压在90至160mmHg范围内(含临界值),舒张压在60至100mmHg范围内(含临界值),首次不达标的受试者允许复测,如果连续两次复测达标,则符合此标准,如果复测1次不达标则不再进行复测;
2)随机前每天接受稳定剂量的他汀类药物(辛伐他汀、阿托伐他汀或瑞舒伐他汀)≥28天,且在参与研究期间没有他汀种类及剂量改变计划;
排除标准
1.有心血管、呼吸、消化、泌尿、血液学、内分泌、免疫、皮肤或神经系统疾病的重大疾病病史或患有上述疾病,也包括由研究者确定与临床相关的过去3个月内任何急性疾病或外科手术;已知会影响血脂或脂蛋白水平的任何具有临床意义的未控制的内分泌疾病或免疫系统疾病。
2.当前患有需要使用抗生素、抗真菌药、抗寄生虫药或抗病毒药治疗的感染;
3.近10年内有任何恶性肿瘤病史;
4.既往患有甲状腺相关疾病和/或筛选期甲状腺功能检查异常且有临床意义;
5.筛选期实验室检查[包括血常规、血生化、尿常规、凝血功能、甲状腺功能及抗体、血妊娠(仅育龄女性)]经研究者判断异常且有临床意义(B部分MAD符合其入组标准的血脂相关指标升高异常以及因长期稳定应用他汀类药物导致的谷丙转氨酶(ALT)和谷草转氨酶(AST)≤2.0×正常值上限不作为排除依据);
6.筛选期传染病筛查乙肝表面抗原(HBsAg)、丙型肝炎抗体(HCVAb)、梅毒抗体、人类免疫缺陷病毒(HIV)抗体检测阳性者;
7.患有胃肠道、肝脏、肾脏或其他已知干扰药物吸收、分布、代谢或排泄的疾病;
8.在研究药物首次给药之前的12个月内有滥用药物或之前的3个月内有酗酒史[平均每天摄入的酒精量超过15g(15g酒精相当于360mL啤酒或150mL葡萄酒或50mL酒精量为40%的白酒),或酒精呼气试验阳性者)];
9.经证实具有临床意义(需要干预,例如,急诊室就诊、肾上腺素治疗)的过敏反应(例如,食物、药物或特应性反应、哮喘发作),研究者认为其会干扰受试者参与试验的能力;已知对任何研究药物成分过敏;
10.在研究药物首次给药之前30天内使用任何活疫苗;
11.妊娠、哺乳期女性;
12.在研究药物首次给药之前3个月内献血或血浆,或损失全血500mL以上,或在研究药物首次给药前1年内接受输血;
13.在研究药物首次给药之前90天内参与过另一项研究性临床试验;
14.研究者认为存在任何不适宜参加本试验的其它因素;
15.SAD受试者附加排除标准:在研究药物首次给药之前的14天或药物的5个半衰期内(以较长者为准),使用任何处方药和非处方药(包括中药、保健品、具有减肥作用的药物(如奥利司他)等,除非研究者和申办方均认为无临床相关性,且不会影响血脂水平;
16.MAD受试者附加排除标准:
1)在首次给药之前14天或药物的5个半衰期内(以较长者为准),使用方案规定外任何处方药物和非处方药(包括中药、保健品、具有减肥作用的药物(如奥利司他)等,除非研究者和申办方均认为无临床相关性,且不会影响血脂水平),允许服用降压药物(每个受试者最多2种降压药,且在整个研究期间保持品种、剂量稳定),他汀联用受试者允许按照方案规定服用稳定剂量的辛伐他汀、阿托伐他汀或瑞舒伐他汀;
2)患有纯合子型家族性高胆固醇血症(HoFH),经临床诊断或存在既往病史;
3)继发性血脂异常:由于其他疾病所引起的血脂异常:如肥胖、糖尿病、肾病综合征、甲状腺功能减退症、肾功能衰竭、肝脏疾病、系统性红斑狼疮、糖原累积症、骨髓瘤、脂肪萎缩症、急性卟啉病、多囊卵巢综合征等或药物原因的血脂异常:如噻嗪类利尿剂、β受体阻滞剂、糖皮质激素等。
研究者信息
主要研究者
姓名:崔一民
学位:临床药理学博士
职称:主任药师
单位名称:北京大学第一医院
各参加机构
| 序号 | 机构名称 | (主要)研究者 | 省-市(区) | 地址 |
| 1 | 北京大学第一医院 | 崔一民 | 北京市-西城区 | 北京市西城区西什库大街8号 |
| 2 | 中南大学湘雅医院 | 秦群 | 湖南省-长沙市 | 长沙市开福区湘雅路87号 |
