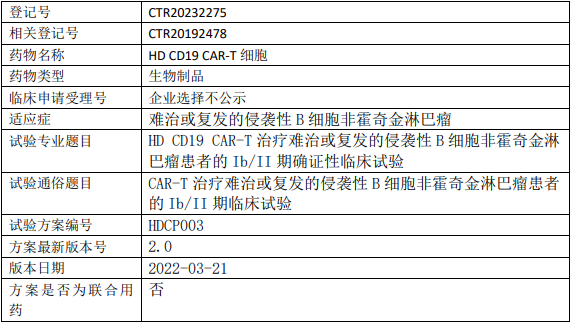
华道生物HD CD19 CAR-T临床试验,HD CD19 CAR-T细胞注射液治疗难治或复发的侵袭性B细胞非霍奇金淋巴瘤的Ib/II期确证性临床试验
试验目的
第一阶段(Ⅰb期)
评估HD CD19 CAR-T在临床推荐剂量4×10^6 CAR+ cells/kg治疗目标适应症的安全性。
第二阶段(Ⅱ期)
评估HD CD19 CAR-T细胞治疗r/r B-NHL患者的有效性。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、签署知情同意书,并愿意而且能够遵守试验流程表规定的访视、治疗方案、实验室检查,及研究的其他要求。
2、年龄≥18周岁,男女不限。
3、东部肿瘤协作组(ECOG)体力状态评分0~1分。
4、预期寿命≥3个月。
5、经确诊的CD19阳性的r/r B-NHL患者:
●根据WHO2016标准经细胞学或病理学确诊的DLBCL(含FL伴DLBCL、FL转化为DLBCL、DLBCL的非特殊亚型及特殊亚型如PMBCL)、3b FL患者、高级别B细胞淋巴瘤(DHL/THL/NOS)患者。
●经规范的一线治疗且二线治疗至少2疗程(干细胞移植后复发者除外),使用过CD20靶向药物及蒽环类药物。
●其中,复发性或难治性的定义(参考NCCN指南《B细胞淋巴瘤(2020.V4)》)包括下列之一:
a.造血干细胞移植(SCT)后复发或进展,进入移植复发序列; b.经至少二线治疗后评估为SD/PD,则进入二线后难治序列;
c.经至少二线治疗后评估为CR后再次复发,则进入二线后复发序列;
d.对于由其他低级别淋巴瘤经至少一线治疗后转化为高级别的淋巴瘤(含FL转化为DLBCL等),再经一线治疗后评估为SD/PD,则进入二线后难治序列;
e.对于由其他低级别淋巴瘤经至少一线治疗后转化为高级别的淋巴瘤(含FL转化为DLBCL等),再经一线治疗后评估为CR后再次复发,则进入二线后复发序列。
6、至少有一个可测量病灶(Lugano 2014标准)以作为评估依据对于结内病灶,应长径≥1.5cm且短径≥1.0cm;对于结外病灶,应长径≥1.0cm(筛选期接受知情同意前本院30天内的影像学检测数据,且中途未经其他抗肿瘤治疗)。
7、重要器官的功能水平必须符合下列标准:
a.血清肌酐≤1.5倍正常值上限(ULN);
b.ALT和AST≤2.5 ULN;总胆红素≤1.5 ULN;
c.血液动力学稳定且左心室射血分数(LVEF)≥50%;
d.血红蛋白≥90g/L;血小板计数≥75×10^9/L;中性粒细胞绝对计数(ANC)≥1.0×10^9/L;
e.需有最低的肺功能储备(呼吸困难不高于1级(按照CTCAE5.0标准)和室内条件情况下经皮动脉血氧饱和度>91%)。
8、有生殖能力的男性或有怀孕可能性的女性患者必须满足其一:
a.已手术绝育;
b.女性患者绝经≥2年或筛选期血清妊娠试验阴性;
c.同意在筛选至细胞输注后2年内使用高度有效的避孕方法,例如口服避孕药、宫内避孕器或屏障避孕法结合杀精剂。
排除标准
1、筛选前2年内患有除目标适应症以外的其他恶性肿瘤病史的患者(筛选2年前已接受过根治治疗且无复发的恶性肿瘤患者除外、非黑色素瘤皮肤癌患者、基底细胞或鳞状上皮细胞皮肤癌患者、局部前列腺癌患者、导管原位癌、乳头状或滤泡状甲状腺癌患者、其他淋巴瘤转化为侵袭性淋巴患者及原位癌患者除外)。
2、Richter综合征患者,以及诊断为白血病的患者。
3、入组(单采)前6周内接受过自体造血干细胞移植的患者。
4、曾接受过针对CD19的靶向治疗,CAR-T治疗,或者其他基因修饰的T细胞治疗的患者。
5、入组(单采)前2周内接受过抗体治疗(包括抗CD20抗体)、放疗或化疗的患者。
6、入组(单采)前4周内接受过大型手术者,或拟在研究期间进行手术者。
7、筛选时有活动性乙肝(HBV-DNA拷贝数>10^5copies/ml,HBsAg和HBcAb若均为阴性可免于进行HBV-DNA检测)、活动性丙肝(HCV-RNA拷贝数>ULN,HCV抗体阴性可免于进行HCV-RNA检测)、HIV感染(HIV-RNA阳性或抗体阳性)、梅毒螺旋体感染(TP抗体阳性)的患者。
8、中枢神经系统(CNS)淋巴瘤,或NHL发生脑转移,或脑脊液检测出恶性肿瘤细胞。
9、患有可能限制患者参与临床试验的严重基础疾病,依研究者判断而定,包括但不局限于:严重的免疫系统抑制、控制不佳的糖尿病、胃溃疡、活动性自身免疫性疾病、深静脉栓塞、肺动脉栓塞等。
10、患有严重心脏疾病的患者,包括但不仅限于:按纽约心脏协会分类(NYHA)3或4级充血性心衰;控制不佳的心绞痛或心律失常;任何控制不佳的高血压、低血压、严重的心血管疾病。
11、筛选时有控制不佳的全身真菌、细菌、病毒或其他感染的患者。
12、在筛选前的30天内参加过其他药物临床研究或本研究期间拟参加其他药物临床试验的患者。
13、患者正接受或在入组(单采)前2周内已经接受了高剂量(60mg地塞米松或相当剂量的其他糖皮质激素药物)的系统性糖皮质激素药物治疗,或经研究者判定研究期间需要长期使用系统性类固醇治疗的受试者(标准剂量的糖皮质激素药物的体表使用、吸入性或局部使用,以及生理性替代治疗肾上腺功能不足者除外)。
14、已知过敏体质或对于本试验药物(包括HD CD19 CAR-T、环磷酰胺、氟达拉滨)及产品成分有高敏反应的病史者。
15、任何可能干扰本研究药物的安全性和有效性评估的其他医学状况。
16、怀孕和哺乳期女性。
17、研究者判断为不适合入组的其他情况。
