正大天晴TQB3909临床试验,TQB3909片治疗复发或难治性套细胞淋巴瘤安全性及有效性的Ib/II期临床试验
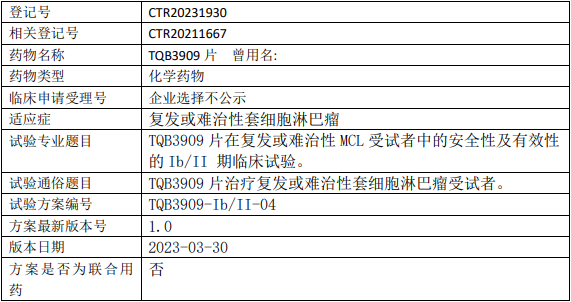
试验目的
评价TQB3909片单药治疗复发或难治套细胞淋巴瘤(MCL)者中的安全性和取得2期推荐剂量。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、受试者自愿加入本研究,签署知情同意书,依从性好。
2、年龄:≥18周岁(签署知情同意书时);ECOGPS评分:0-2分;预计生存期超过3个月。
3、主要器官功能良好,符合下列标准:
a)血常规检查标准(检查前7天内未输血、未使用造血刺激因子类药物纠正):中性粒细胞绝对值(NEUT)≥1.0×10^9/L(或≥0.75×10^9/L,对于淋巴瘤骨髓浸润患者);血小板计数(PLT)≥75×10^9/L(或≥50×10^9/L,对于淋巴瘤骨髓浸润患者);
b)生化检查需符合以下标准:
i.总胆红素(TBIL)≤2倍正常值上限(ULN);丙氨酸基转移酶(ALT)和天门冬氨酸基转移酶(AST)≤3×ULN;
ii.血清肌酐(Cr)≤1.5×ULN或根据Cockcroft-Gault肾小球滤过公式估算的肌酐清除率≥50mL/min;
iii.血清钾<5.0mmol/L;
c)凝血功能检查需要符合以下标准:凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、国际标准化比值(INR)≤1.5×ULN(未接受过抗凝治疗)。
4、患者的CT/MRI显示有可测量病灶,定义为≥1个淋巴结的最长直径>1.5cm或≥1个结外病灶的最长直径>1.0cm,可通过≥2个垂直维度测量。
5、育龄女性受试者应同意在研究期间和研究结束后6个月内必须采用避孕措施(如宫内节育器、避孕药或避孕套);在研究入组前的7天内血清妊娠试验阴性,且必须为非哺乳期受试者;男性受试者应同意在研究期间和研究期结束后6个月内必须采用避育措施。
排除标准
1、合并疾病及病史:
a)首次用药前3年内出现过或当前同时患有其它恶性肿瘤。以下两种情况可以入组:经单一手术治疗的其他恶性肿瘤,达到连续5年的无疾病生存(DFS);治愈的子宫颈原位癌、甲状腺癌、非黑色素瘤的皮肤癌和表浅的膀胱肿瘤[Ta(非浸润性肿瘤),Tis(原位癌)和T1(肿瘤浸润基膜)];
b)已知淋巴瘤累及中枢神经系统(CNS);
c)既往接受过异基因造血干细胞移植;
d)首次用药前3个月内接受过自体造血干细胞移植;
e)具有影响口服药物的多种因素(比如无法吞咽、慢性腹泻和肠梗阻、炎症性肠病、吸收不良综合征等);
f)由于任何既往治疗引起的≥CTCAE2级的未缓解的毒性反应(脱发、ANC和血小板异常除外,ANC和血小板要求遵循入选4);
g)研究治疗开始前28天内接受了重大外科治疗、明显创伤性损伤;
h)首次用药前3个月内发生过动/静脉血栓事件,如脑血管意外(包括脑出血、脑梗塞,腔隙性脑梗死除外)、深静脉血栓(深静脉置管继发除外)及肺栓塞等;
i)具有精神类药物滥用史且无法戒除或有精神障碍者;
j)存在任何重度和/或未能控制的疾病的受试者,包括:
i.首次用药前6个月内患有≥2级心肌缺血或心肌梗塞、心律失常(男性QTcF>450ms,女性QTcF>470ms)及≥2级充血性心功能衰竭(纽约心脏病协会(NYHA)分级)、心脏彩超评估左室射血分数(LVEF)<50%;控制不良的高血压,定义是在筛选时至少连续2次血压测量显示收缩压>170mmHg,舒张压>105mmHg;
ii.存在活动性感染(≥CTCAE2级感染);
iii.活动性肝炎:
a.乙肝病毒感染,HBVDNA阳性或拷贝数超过研究中心正常值上限者;备注:符合入组条件的HBsAg阳性者,建议持续抗病毒治疗(推荐核苷类似物),并每3~6个月监测一次HBVDNA;HBcAb阳性但HBsAg阴性受试者,可每3~6个月监测一次HBVDNA,若病毒被激活需进行抗病毒治疗;
b.HCV抗体阳性,且HCV病毒滴度检测值超过正常值上限;
iv.有免疫缺陷病史,包括HIV阳性或患有其它获得性、先天性免疫缺陷疾病,或有器官移植史者;
v.患有癫痫并需要治疗者。
2、肿瘤相关症状及治疗:
a)首次用药前4周内曾接受过化疗、放疗,首次用药前12周接受过免疫检查点抑制剂、CAR-T治疗,首次用药前接受的其它小分子抗肿瘤治疗(从末次治疗结束时间开始计算洗脱期)在5个半衰期内;
b)既往接受过BCL-2抑制剂。
3、研究治疗相关:首次用药前4周内接受过活疫苗,或参加研究期间计划接种疫苗;注:季节性注射的流感疫苗通常是灭活疫苗,因此允许使用。如果根据当地惯例的推荐,使用灭活冠状病毒(COVID-19)疫苗允许入组。
4、首次用药前4周内参加过其他抗肿瘤药物临床试验。
5、根据研究者的判断,有严重危害受试者安全或影响完成研究的伴随疾病者,或认为存在其他原因不适合入组的受试者。
6、对别嘌醇及苯溴马隆均过敏。
