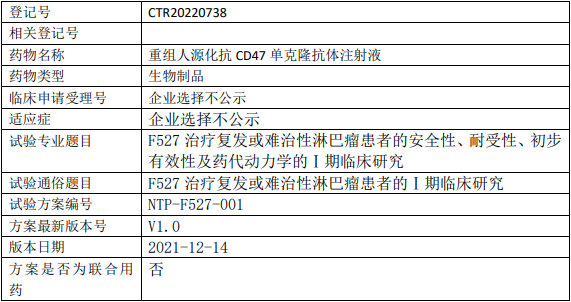
新时代药业F527临床试验,重组人源化抗CD47单克隆抗体注射液(F527)治疗复发或难治性淋巴瘤患者的安全性、耐受性、初步有效性及药代动力学的Ⅰ期临床试验
试验目的
1、评估F527在复发或难治性淋巴瘤患者中的安全性和耐受性;
2、通过剂量递增评估F527在复发或难治性淋巴瘤患者中的剂量限制毒性(DLT)的发生情况,并确定最大耐受剂量(MTD)和/或Ⅱ期推荐剂量(RP2D)。
试验设计
试验分类:其他其他说明:安全性、耐受性、初步有效性及药代动力学的Ⅰ期临床研究
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至80岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄≥18且≤80周岁的男性或女性
2、经组织病理学确诊的复发/难治性淋巴瘤患者;复发/难治性定义为:患者在最新一个全身性治疗方案后未达缓解(包括完全缓解或部分缓解),或达到缓解后疾病进展或复发。
3、受试者必须有至少一个经研究者评估认为可测量的病灶(淋巴结长径>15mm,结外病灶长径>10mm);
4、美国东部肿瘤协作组(ECOG)评分体能状态为0-2分;
5、预期生存期≥3个月;
6、重要器官的功能符合下列要求(首次给药前7天内不允许使用任何血液成分及细胞因子的药品):
●血常规:中性粒细胞计数≥1.5×109/L;血小板计数≥75×109/L;血红蛋白≥95g/L;
●肝功能:TBIL≤1.5×ULN,ALT和AST≤2.5×ULN;如存在肝脏转移,则ALT和AST≤5×ULN;
●肾功:肌酐≤1.5×ULN;
●凝血功能:国际标准化比值(INR)≤1.5×ULN和活化部分凝血活酶时间(APTT)≤1.5×ULN;
7、理解试验步骤和内容,并自愿签署知情同意书。
排除标准
1、特殊类型的淋巴瘤如原发/继发中枢神经系统淋巴瘤等
2、近5年内有其他恶性肿瘤病史者,但局部可治愈的癌症除外(如基底细胞或鳞状细胞皮肤癌、浅表膀胱癌或前列腺、宫颈或乳腺原位癌等)
3、最近三个月有溶血性贫血或埃文斯综合征病史
4、直接抗人球蛋白试验阳性
5、既往使用过CD47靶向药物或信号调节蛋白α(SIRPα)靶向药物治疗者
6、首次给药前2周内接受过抗肿瘤化疗、放疗、生物治疗或免疫治疗/免疫调节治疗等抗肿瘤相关治疗;既往抗肿瘤治疗的毒性未恢复至≤1级(脱发除外)者
7、有器官移植或异基因骨髓移植病史或首次给药前3个月内接受过自体干细胞移植或有其他严重免疫缺陷者
8、HIV阳性患者、梅毒感染者(RPR阳性且TPPA阳性者)或活动性肝炎者(HBsAg阳性和/或HBcAb阳性,且HBV-DNA阳性或高于正常值上限者;HCV抗体阳性且HCV-RNA阳性或高于正常值上限)
9、有无法控制的或严重的心血管疾病者,首次给药前6个月内出现纽约心脏病协会(NYHA)Ⅱ级以上充血性心力衰竭、不稳定型心绞痛、心肌梗塞等心血管疾病;难以控制的高血压(收缩压≥180mmHg和/或舒张压≥100mmHg)者
10、首次给药前4周内曾接受其他任何临床试验药物治疗者
11、首次给药前4周内曾接受过减毒活疫苗接种者
12、有严重过敏史,或已知受试者既往对大分子蛋白制剂/单克隆抗体,以及对任何试验用药品组成成分过敏者
13、有精神病史或药物滥用史的患者
14、妊娠或者哺乳期妇女,研究期间至末次给药后6个月内有妊娠计划的女性患者或男性患者伴侣,试验期间不愿采用一种医学认可的有效避孕措施(如宫内节育器或避孕套)者
15、经研究者判断不适合入组者
