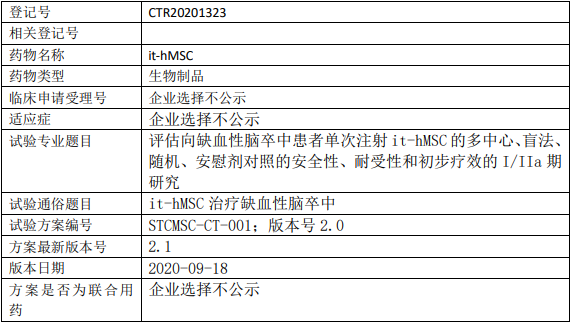
九芝堂美科it-hMSC临床试验,评价同种异体骨髓间充质干细胞产品it-hMSC治疗向缺血性脑卒中I/IIa期的临床试验
试验目的
主要目的
评估对缺血性脑卒中患者静脉注射it-hMSC的安全性和耐受性。
次要目的
评估it-hMSC的治疗具有神经和运动功能障碍的缺血性脑卒中患者的临床疗效。
试验设计
试验分类:安全性和有效性
试验分期:其它I/II期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1.男性和女性≥18岁
2.病史显示,临床诊断为缺血性脑卒中的时间超过6个月
3.首次诊断时和入选时的影像学结果表明患有缺血性脑卒中并存在功能障碍
4.存在与第2条中的诊断相关的严重神经功能障碍,导致受试者需要他人协助才能行走,或不能独立完成一般日常生活活动
5.入选时NIHSS得分6-20
6.预期寿命大于12个月
7.治疗前,患者接受了缺血性脑卒中二级预防标准医疗护理,包括但不限于适当的血压和胆固醇控制措施、使用抗血小板药或抗凝药物(禁用情况除外)
8.能理解并提供已签字的知情同意书,或者让指定的法定监护人或配偶自愿代表受试者做出上述决定
9.合理期待患者将得到缺血性脑卒中二级预防标准医疗护理,并参加所有计划的安全随诊
10.根据下列标准确定的器官功能:
血清谷草转氨酶(AST)≤2.5×正常上限(ULN)。
血清谷丙转氨酶(ALT)≤2.5×正常上限。
总血清胆红素≤1.5×正常上限;在没有接受抗血栓治疗的受试者中,凝血酶原时间(PT)和部分凝血激酶时间(PTT)≤1.25×正常上限。
血清白蛋白≥3.0g/dL;嗜中性细胞绝对计数(ANC)≥1,500/μL;血小板≥150,000/μL;血红蛋白≥9.0g/dL;血清肌酸酐≤1.5×正常上限;血清淀粉酶或脂肪酶≤1.0×正常上限
11.入选研究前2个月神经功能或功能缺陷没有实质性改善
排除标准
1.癫痫病史
2.肿瘤病史
3.脑肿瘤、脑外伤病史
4.乙肝五项表面抗原、e抗原、e抗体和核心抗体任意一项阳性,丙型肝炎病毒抗体阳性,梅毒血清抗体阳性或艾滋病毒抗体阳性
5.参与试验前六个月内发生心肌梗塞
6.患有其他任何具有临床意义的医学疾病,或存在精神或检验结果异常,经研究者或申办方判定参加试验会给受试者带来安全风险
7.影像学检查提示过去12个月内出现蛛网膜下腔出血或脑内出血
8.治疗前3个月内参与另一项使用试验药物或设备的研究
9.参与过其它干细胞治疗相关研究
10.过去一年吸毒或酗酒史
11.已知怀孕、哺乳或妊娠测试阳性(将在筛查过程中进行检测)或计划在试验期间怀孕的女性
12.对牛和猪肉产品过敏
研究者信息
主要研究者
姓名:王拥军
学位:博士
职称:主任医师、教授
单位名称:首都医科大学附属北京天坛医院
参加医院
医院名称:首都医科大学附属北京天坛医院
主要研究者:王拥军
医院地址:北京市丰台区南四环西路119号
